**梯队PD-1/PD-L1免疫抑制剂 适应症成主战场
来源:GBIHealth 2020-07-06 12:32
2015年,中国医药行业出台了一系列重磅政策,而PD-1/PD-L1免疫检查点抑制剂的审批进程最能代表这些政策给中国生物制药市场带来的变化。2018年6月,美国百时美施贵宝(BMS)旗下欧狄沃(纳武利尤单抗注射液)正式获得国家药品监督管理局(NMPA)批准上市,成为中国第一款上市的PD-1单抗药物,距美国获批上市仅4年。随后的两年里,中国迅速批准
2015年,中国医药行业出台了一系列重磅政策,而PD-1/PD-L1免疫检查点抑制剂的审批进程最能代表这些政策给中国生物制药市场带来的变化。
2018年6月,美国百时美施贵宝(BMS)旗下欧狄沃(纳武利尤单抗注射液)正式获得国家药品监督管理局(NMPA)批准上市,成为中国第一款上市的PD-1单抗药物,距美国获批上市仅4年。随后的两年里,中国迅速批准了7种PD-1/PD-L1免疫抑制剂,其中包括4款国产PD-1单抗。
在竞争日趋白热化的PD-1/L1赛道,头部药企试图拉开彼此之间以及与后续大部队的距离。GBI将分两次对PD-1/L1单抗研发现状进行回顾,本期将对在国内研发的PD-1/L1抗体药物现状做一概览。
01、首轮获批的PD-1/PD-L1免疫抑制剂
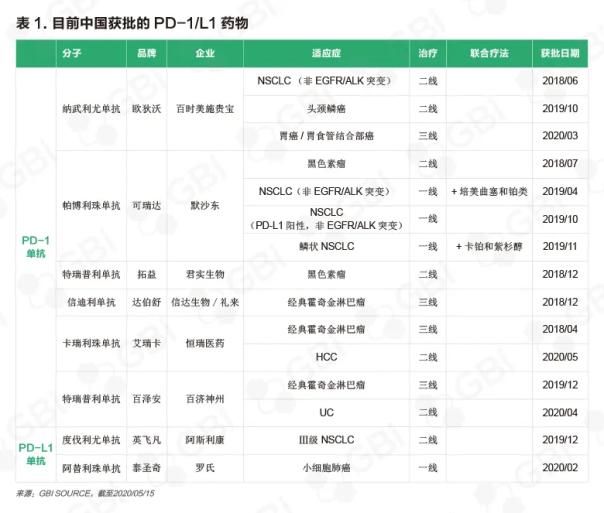
从2018年6月到2020年5月,一共有8种PD-1/L1药物获得NMPA批准上市,涵盖15种适应症,其中4种药物来自于跨国药企(表1)。从全球发展趋势来看,在PD-1/L1市场上,各家公司都试图率先拿下某适应症的批准,以获得先动优势。BMS重磅PD-1抑制剂欧狄沃率先在中国获批用于经治晚期非小细胞肺癌(NSCLC)治疗,后面又获批头颈癌和胃癌、胃食管结合部癌适应症。而默沙东(MSD)的可瑞达(帕博利珠单抗)以4种适应症批准领先,其中包括3个NSCLC适应症。
全球获批但还未在中国上市的PD-1/L1抗体有2个,分别是默克/辉瑞的PD-L1单抗Bavencio(avelumab)和赛诺菲/再生元的PD-1单抗Libtayo(cemiplimab),于2017年3月和2018年9月获美国FDA批准上市,目前正在中国进行临床试验。自2014年以来, PD-1/PD-L1抑制剂共有54种适应症获得美国FDA批准(见完整版报告附录),其中可瑞达获批23种,欧狄沃获批16种;相比之下,中国市场仍有巨大的潜力。
02、国内药企彰显中国速度优势
国内药企最初瞄准的是经典霍奇金淋巴瘤(cHL)和黑素瘤等相对容易研发成功的适应症,且临床试验和患者的招募也相对顺利。随后,企业在其他重大治疗领域采取了先动优势的策略。例如,恒瑞医药艾瑞卡(卡瑞利珠单抗)和百济神州百泽安(替雷利珠单抗)分别在2020年3月和4月获批第2个适应症,用于治疗晚期肝细胞癌(HCC)和局部晚期或转移性尿路上皮癌(UC),成为国内首个获批HCC和UC的PD-1单抗。
毫无疑问,国内PD-1/PD-L1这条赛道现已非常拥挤;但是国内依然有大量从未接受过此类药物治疗的患者群,药企仍有很大的开发空间。一项最新研究发现,国内临床试验单药治疗的患者招募率几乎是美国的6倍,联合疗法是美国的4倍。GBI SOURCE数据显示,4个首批国产PD-1/PD-L1药物自首次进入临床试验到首个适应症获批最长用时40个月(恒瑞医药艾瑞卡),最短仅27个月(信达生物达伯舒),百济神州的百泽安从启动鳞状非小细胞肺癌的临床试验到该适应症补充申请提交仅用了不到20个月。而跨国公司不同,从首次临床试验批准到首次适应症获批用时长达42~65个月。
03、新版医保目录带来利好
2019年9月,国家医保局(NHSA)正式启动国家医保目录准入价格谈判,2018年底以前获批的4种PD-1药物将有机会进入目录。最终仅有信达生物/礼来的达伯舒进入,价格由原来的7838元/100mg降至2843元/100mg(约407.01美元),降幅达63.74%。达伯舒进入医保后,提高了该药在医院药房中的患者可及性。根据礼来公司财报,2019年达伯舒在中国市场的销售额为1.34亿美元,2020年第一季度的销售额为5,700万美元,高于上年同期的1,000万美元。
即使没有进入医保,新上市的PD-1/L1抑制剂市场表现也相对强势。据君实生物财报显示,2019年拓益销售额为7.74亿元人民币(约1.08亿美元),而恒瑞制药未公布艾瑞卡的销售额,但估计已达10亿元。百济神州于今年3月在新冠疫情期间推出了百泽安,在短短几周内便创造了2100万美元的收入(包括分销商的预购订单)。
06、临床开发趋势
据Clinicaltrials.gov和ChiCTR.gov.cn的公开信息,GBI整理了已获批上市的8种PD-1/L1药物计划或正在中国进行的临床试验信息(见表4)。截至2020年5月15日,这8种药物共有258项Ⅰ~Ⅲ期中国临床试验正在进行。
根据不同的适应症,肺癌的临床试验最多,占31%;胃癌和肝/胰腺癌分别占18%和10%,居第二和第三。国产的4种药物每个都至少覆盖了6种适应症,其中恒瑞艾瑞卡和君实生物拓益研发进展最快,正在进行8种适应症的临床试验(不包括未指明具体癌种的适应症)。
08、即将获批的上市申请
在中国目前PD-1/L1药物提交的众多适应症NDA和sNDA申请中(表6),肺癌的联合治疗方案占绝大多数,下期报告将对这方面进行详细探讨。值得注意的是,君实生物拓益此次上市申请的适应症为二线或以上全身治疗失败的复发/转移性鼻咽癌,有望成为全球首个获批此适应症的PD-1药物。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


