CAR-T细胞疗法研究进展(第15期)
来源:本站原创 2020-06-30 23:57
2020年6月30日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样
2020年6月30日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被
认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Angew Chem:重大进展!开发出利用小分子进行化学编程的开关型CAR-T细胞疗法
doi:10.1002/anie.202005432
虽然两种CAR-T细胞疗法---诺华公司的tisagenlecleucel(商品名Kymriah)和吉利德公司的axicabtagene ciloleucel(商品名Yescarta)---已被美国食品药品管理局(FDA)批准用于治疗白血病和淋巴瘤,但是它们对占所有癌症90%的实体恶性肿瘤的治疗效果仍有待临 床证实。一个主要的障碍是肿瘤的免疫抑制环境能阻止T细胞的浸润、激活和招募。另一个挑战是鉴定在癌细胞表面上选择性表达的细胞表面受体,CAR-T细胞特异性地靶向该细胞表面受体,从而使得它们不伤害健康的细胞和组织。在这方面,癌细胞表面组(cancer cell surfaceome, 指的是位于癌细胞表面上的全部大分子)的口袋组(pocketome,指的是在细胞表面上的每个大分子中存在的全部结合位点)部分,包括癌细胞表面受体及其复合物上的小分子结合位点,从而提供了一个较大的药物可靶向的空间,该空间只有小分子才能进入 。因此,小分子可以作为包括抗体在内的天然识别库的补充。然而,与抗体相比,小分子在癌症免疫治疗中具有不合适的药代动力学和药效学特性。人们试图利用各种化学编程抗体、化学编程双特异性抗体以及相关概念解决这些缺点,而且也有人报道了能够赋予小分子 募和激活CAR-T细胞能力的方法。
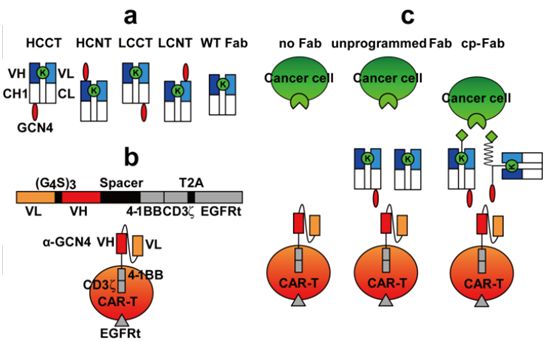
在利用常规的抗体Fab片段控制的开关型CAR-T细胞平台的基础上,来自美国国家癌症研究所、斯克里普斯研究所和德国维尔茨堡大学医院的研究人员将这种平台调整为由化学编程Fab(chemically programmed Fab, cp-Fab)控制。这有效地将对T细胞招募和激活的控制转 移到靶向癌细胞表面受体的小分子上。cp-Fab是在体外组装的,可用于在体外或体内激活CAR-T细胞。这种cp-Fab/CAR-T系统具有高度的通用性,唯一可变的成分是小分子,因此能够广泛地利用CAR-T细胞的力量探究细胞表面大分子的结合位点。相关研究结果近期发表在 Angewandte Chemie期刊上,论文标题为“Chemically Programmable and Switchable CAR‐T Therapy”。
为了对cp-Fab/CAR-T系统进行概念验证,这些作者着重关注靶向叶酸受体1(FOLR1)的叶酸结合位点。FOLR1是一种糖基磷脂酰肌醇(GPI)锚定的糖蛋白,它以纳摩尔的亲和力结合叶酸,从而促进受体介导的内吞作用。快速生长的实体恶性肿瘤,包括卵巢癌和肺癌,都 依赖于叶酸进行代谢和核酸合成。为了与健康细胞和组织竞争叶酸,FOLR1在这些癌症中高度过度表达。这使得FOLR1成为基于小分子和抗体的诊断和治疗试剂---包括CAR-T细胞和携带双特异性抗体的化学编程T细胞---的一个有吸引力的靶点。靶向FOLR1的常规CAR-T细胞 也有报道,并已转化为用于卵巢癌治疗的I期临床试验。在之前的这些研究的基础上,这些作者选择探索FOLR1的叶酸结合位点作为cp-Fab/CAR-T的代表性靶点。
2.IJC:新研究指出制造CAR-T细胞产品的成本可大幅降低
doi:10.1002/ijc.33156
嵌合抗原受体(CAR)T细胞(CAR-T)疗法是一种新的、在某些情况下非常有效的免疫疗法,可用于治疗某些类型的血液癌症和淋巴系统癌症。然而,这种有前途的治疗方法是有成本的。制造商为单个患者制造CAR-T细胞的收费高达32万欧元。在一项新的研究中,通过确 定所涉及的固定成本和可变成本,来自德国癌症研究中心(DKFZ)的研究人员确定,这类细胞免疫疗法可以在DKFZ这样的科研机构生产,而成本只有十分之一左右。相关研究结果于2020年6月14日在线发表在International Journal of Cancer期刊上,论文标题为“Cost of decentralized CAR T cell production in an academic non‐profit setting”。
两种商业化的CAR-T细胞产品已被批准用于治疗急性淋巴细胞T细胞白血病和非霍奇金淋巴瘤,如弥漫性大细胞B细胞淋巴瘤。只有在其他治疗方案失败的情况下才会使用它们。这种治疗方法通常是有效的:治疗两年后,40%~60%的患者没有复发。
然而,这种有前途的、高度个体化的治疗是有成本的:在德国,制造商为每名患者生产CAR-T细胞的费用高达32万欧元。DKFZ卫生经济学家Michael Schlander解释说,“CAR-T细胞疗法仍然只在少数癌症患者中可行,不过这种疗法将有望能够推广到其他类型的癌症。人们 相当担心我们的医疗系统将无法支付患者人数可能增加而带来的费用增加。”
3.Science子刊:利用表达FOXP3蛋白的TCR-T细胞治疗1型糖尿病已接近临床
doi:10.1126/scitranslmed.aay6422
在一项新的研究中,Rawlings及其研究团队与贝纳罗亚研究所主席Jane Buckner博士着重关注T细胞,即免疫系统中抗击疾病的白细胞。相关研究结果发表在2020年6月3日的Science Translational Medicine期刊上,论文标题为“Gene editing to induce FOXP3 expression in human CD4+ T cells leads to a stable regulatory phenotype and function”。
在1型糖尿病中,称为效应T细胞的特定类型免疫细胞会错误地攻击胰腺中产生胰岛素的胰岛细胞。这些胰岛细胞的职责是感知血液中葡萄糖水平上升,并通过释放胰岛素作出反应。由于免疫系统的其他组成部分---调节性T细胞(Treg)---不能正常发挥作用,所以这种攻 击仍在继续。
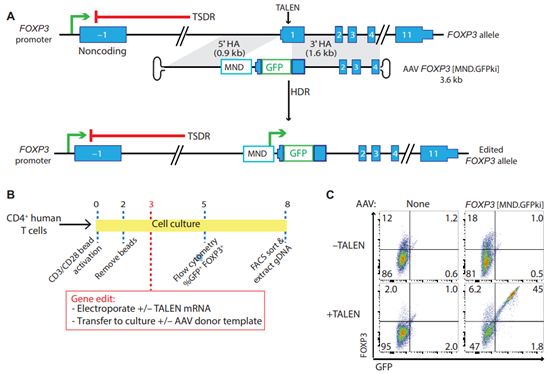
为了阻止这种攻击,Rawlings实验室设计了一种方法:对患者自身的T细胞进行基因改造,使得它们像正常的Treg细胞一样发挥作用。他们希望当移植回患者体内时,这些经过基因改造或者说基因编辑的调节样T细胞(edited regulatory-like T cell, edTreg)进入胰腺 ,在那里它们可以帮助抑制过度活跃的免疫反应,从而维持和保护这些胰岛细胞的功能。
这篇论文展示了这些研究人员是如何利用基因编辑技术来靶向人T细胞中的FOXP3基因的。通过激活FOXP3,他们为T细胞提供了形成Treg细胞所需的指令。
由此产生的edTreg细胞看起来与天然Treg细胞非常相似。当在动物模型和组织培养物中进行测试时,它们的功能也像天然Treg细胞。最后,这些研究人员展示了他们如何让这些经过基因改造的细胞具有抗原特异性。根据Rawlings的说法,这一功能是通过将T细胞受体 (TCR)附着在这些经过基因改造的细胞的表面上来实现的,这对于将这些细胞引导到糖尿病患者的胰腺中将是至关重要的。
进一步验证这些结果的研究将有助于为针对1型糖尿病细胞疗法的I期临床试验铺平道路。他说,“这些数据首次证实通过激活FOXP3的方式进行基因改造足以制造出功能性的edTreg细胞。这不仅是一个里程碑式的研究发现,而且可以直接转化为临床使用。”
4.Nature重大突破!用CAR-T细胞治疗衰老!
doi:10.1038/s41586-020-2403-9
衰老是细胞老化的一个标志,并导致许多疾病。一种使免疫细胞靶向衰老细胞的新方法可能提供更好的治疗选择。衰老是细胞应激反应的一种形式。在某些情况下,它可能是有害的,人们正在努力开发针对衰老细胞的疗法。在《自然》(Nature)杂志上,Amor等人描述 了一种选择性去除小鼠衰老细胞的方法。
作者采用了一种目前用于抗癌治疗的技术。在这种疗法中,T细胞从个体中移除,在回输之前,对其进行操作,以增强其针对癌细胞的能力。这种细胞被称为CAR T细胞,因为它们被设计成表达所谓的嵌合抗原受体(CAR)。CAR的设计目的是识别并结合存在于癌细胞表面的 一种称为抗原的蛋白质的特定片段。如果这种相互作用发生,T细胞就会被激活并杀死肿瘤细胞。识别只在肿瘤细胞上表达的抗原是一个关键的挑战,因为CAR T细胞杀死健康细胞可能导致严重的副作用。
为了找到针对衰老细胞的抗原,Amor和同事分析了衰老的人和小鼠细胞中发现的跨膜蛋白的表达。八个最有希望的候选之一是尿激酶型纤溶酶原激活受体(uPAR)。对先前发表的关于人类组织中蛋白和RNA表达的数据进行的检查显示,uPAR要么未被检测到,要么在人体的大 部分器官(包括中枢神经系统、心脏和肝脏)中以低水平存在。然而,Amor和同事发现uPAR在体内和体外衰老细胞中都有高表达。有趣的是,缺乏跨膜区域的一种可溶性uPAR (suPAR)是SASP反应期间分泌的一种成分。suPAR的存在是一些慢性疾病的标志,包括糖尿病和肾病 ,衰老在这些疾病中起作用。
在确定uPAR作为衰老细胞的普遍标志后,Amor和他的同事设计了靶向uPAR的CAR T细胞。鉴于癌变前的细胞(那些可能在成为癌细胞)出现衰老以及很多抗癌治疗导致肿瘤细胞进入衰老来阻止他们的分裂,作者调查了这些CAR T细胞是否可以有效治疗癌症。他们报告说,以 uPAR为靶点的CAR T细胞治疗可以消除小鼠肝癌和肺癌模型中衰老的前恶性和恶性细胞。已经有人提出,通过后续针对衰老细胞的治疗,抗癌疗法可能会得到改善。Amor和他的同事在小鼠身上的研究证实了这种使用具有senolytic CAR T细胞的方法提高了抗癌治疗的有效 性。
使用senolytic CAR - T细胞的部分吸引力在于其治疗衰老涉及的许多疾病的潜力。事实上,Amor和他的同事证明,如果小鼠接受senolytic CAR T细胞治疗,可以改善非酒精性脂肪性肝炎(一种严重的脂肪肝)动物模型的肝纤维化结果。
5.I期临床试验表明靶向MAGE-A4的TCR-T细胞有望治疗多种实体瘤
新闻来源:Adoptive T-cell therapy ADP-A2M4 targeting MAGE-A4 shows early activity in patients with advanced solid tumors
过继性T细胞疗法ADP-A2M4涉及对来患者体内的T细胞进行基因改造使之表达可识别癌症抗原MAGE-A4的T细胞受体(TCR)。在美国德克萨斯大学MD安德森癌症中心的研究人员的领导下,针对ADP-A2M4的一项I期临床试验在包括滑膜肉瘤、头颈癌和肺癌在内的多种实体瘤的 患者中获得了反应。这项林场试验获得Adaptimmune公司的资助。
在38名接受这种治疗的患者中,ADP-A2M4 T细胞使得9人(23.7%)获得了总体反应(OR)或者说肿瘤缩小,18人(47.4%)病情稳定。在2020年美国临床肿瘤学会年会上,主要研究者、研究性癌症治疗学教授David Hong博士在口头报告中分享这项临床试验的数据。
Hong说,“到目前为止,我们还没有看到用现有的细胞疗法在治疗实体瘤上取得较强的反应,这在很大程度上是因为表达的抗原不限于肿瘤。在这项临床试验中,我很受鼓舞地看到一些患者出现了持久的反应,这些结果表明这种基于TCR-T细胞的新兴技术在治疗实体瘤方 面有潜力。”
6.BMJ子刊:体内研究证实靶向CD123的CAR-T细胞强烈抑制正常的造血功能
doi:10.1136/jitc-2020-000845
近年来,基于CAR-T细胞的细胞免疫疗法在癌症治疗中引发了前所未有的期待。CAR-T细胞免疫疗法涉及对人T细胞进行改造使之表达嵌合抗原受体(CAR),从而引导这些T细胞靶向位于癌细胞表面的肿瘤抗原。由于CAR-T细胞的高疗效、特异性和持久性,它们在B细胞恶性 肿瘤患者中表现出稳健的临床反应。
AML患者面临挑战的原因在于缺乏通用的AML靶抗原来引导CAR-T细胞,以及与健康的造血干细胞/祖细胞(HSPC)具有相同的靶抗原表达,这可能导致危及生命的脱靶细胞毒性。尽管如此,过去的研究已发现利用CD33和CD123重定向的CAR-T细胞治疗AML表现出强劲的抗白血 病活性,并处于临床前和临床开发的后期。
在这些CAR-T细胞是否具有骨髓清除性方面,它们在临床前和临床上产生了一些争议,这是因为它们也可能靶向健康的HSPC,毕竟HSPC是造血或者说血细胞生成所必需的。人们猜测HSPC也在不同程度上表达这些抗原,因此这些CAR-T细胞也可以攻击它们。 西班牙约瑟普-卡雷拉斯白血病研究所干细胞生物学、发育白血病与免疫治疗研究组的研究员Matteo Baroni和及其同事门猜测CAR-T细胞对健康HSPC作用的时间可能比对白血病细胞作用的时间要长。他们认为,之前关于靶向CD123的T细胞的潜在骨髓毒性的研究提供的结果 低估了这些CAR-T细胞的脱靶毒性潜力。
Baroni和他的团队在为期6周的体内研究中提供了大量的证据表明靶向CD123的CAR-T细胞的存在强烈抑制了正常的造血功能,从而造成新血细胞形成的不可逆障碍。相关研究结果于2020年6月10日在线发表在Journal for Immunotherapy of Cancer期刊上,论文标题 为“41BB-based and CD28-based CD123-redirected T-cells ablate human normal hematopoiesis in vivo”。
Baroni声称,“我们呼吁,对于那些经历难治性疾病复发且不能进一步从标准化疗中获益的AML患者,在异体移植之前谨慎使用靶向CD123的CAR-T细胞。对于这些患者来说,存在一个较好的替代选择。这些结果将帮助临床医生考虑靶向CD123的CAR-T细胞持续存在的关键长 期影响,并防止它们用于其他用途。”
7.新研究发现在CAR-T细胞免疫治疗后一个月内感染风险上升
doi:10.1093/ofid/ofaa121
根据一项新的研究,对于接受CD19嵌合抗原受体 (CAR) T细胞(CAR-T)输注的儿童和青少年来说,感染率在治疗后的第一个月增加,然后减少。相关研究结果近期发表在Open Forum Infectious Diseases期刊上,论文标题为“Infectious Complications Following CD19 Chimeric Antigen Receptor T-cell Therapy for Children, Adolescents, and Young Adults”。
美国华盛顿大学西雅图分校的Surabhi B. Vora博士及其同事们回顾了2014年至2017年期间在单一机构接受CD19 CAR-T细胞治疗的83名不大于26岁的患者的医疗记录。他们计算了在治疗前90天、治疗后0~28天和治疗后29~90天的每100天有感染风险的人数。
这些研究人员发现,98%的患者有难治性或复发性的急性淋巴细胞白血病。在治疗前90天内,54%的患者发生感染(感染密度,1.23),而在治疗后28天内,40%的患者发生感染(感染密度,2.89)。在治疗后的29~90天,感染密度降至0.55。大多数感染为细菌性感染或呼 吸道病毒感染(分别为39%和43%)。之前的造血细胞移植,免疫球蛋白G(IgG)水平<400 mg/dL,以及除环磷酰胺(cyclophosphamide)和氟达拉滨(fludarabine)以外的淋巴细胞清除(lymphodepletion)是治疗前与感染相关的危险因素;更严重的细胞因子释放综合 征和IgG<400 mg/dL是治疗后与感染相关的危险因素。
8.Cell Stem Cell:靶向CD133的CAR-T细胞有望治疗胶质母细胞瘤
doi:10.1016/j.stem.2020.04.008
在一项新的研究中,来自加拿大麦克马斯特大学和多伦多大学的研究人员开发出一种很有前景的免疫疗法,可用于治疗一种致命的成人脑癌形式,即胶质母细胞瘤(glioblastoma)。相关研究结果于2020年5月27日在线发表在Cell Stem Cell期刊上,论文标题为“The Rational Development of CD133-Targeting Immunotherapies for Glioblastoma”。
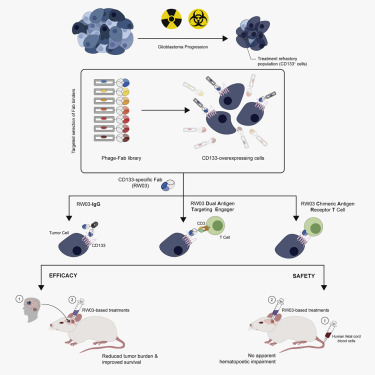
这种称为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的免疫疗法涉及在实验室中对来自患者血液的T细胞进行基因改造,使得它们直接靶向结合胶质母细胞瘤细胞表面上的一种称为CD133的特定蛋白,并消灭这些癌细胞。
当在携带人类胶质母细胞瘤的小鼠身上使用时,靶向CD133的CAR-T细胞疗法被认为是成功的,这是因为它减少了这些小鼠的肿瘤负担,提高了它们的生存率。
来自这项研究的数据促使在加拿大汉密尔顿市成立了一家名为Empirica Therapeutics的脑癌免疫治疗公司。该公司的目标是在2022年之前,针对CD133特异性的CAR-T细胞疗法和其他疗法在复发性胶质母细胞瘤患者中进行临床试验。(生物谷 Bioon.com)
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Angew Chem:重大进展!开发出利用小分子进行化学编程的开关型CAR-T细胞疗法
doi:10.1002/anie.202005432
虽然两种CAR-T细胞疗法---诺华公司的tisagenlecleucel(商品名Kymriah)和吉利德公司的axicabtagene ciloleucel(商品名Yescarta)---已被美国食品药品管理局(FDA)批准用于治疗白血病和淋巴瘤,但是它们对占所有癌症90%的实体恶性肿瘤的治疗效果仍有待临 床证实。一个主要的障碍是肿瘤的免疫抑制环境能阻止T细胞的浸润、激活和招募。另一个挑战是鉴定在癌细胞表面上选择性表达的细胞表面受体,CAR-T细胞特异性地靶向该细胞表面受体,从而使得它们不伤害健康的细胞和组织。在这方面,癌细胞表面组(cancer cell surfaceome, 指的是位于癌细胞表面上的全部大分子)的口袋组(pocketome,指的是在细胞表面上的每个大分子中存在的全部结合位点)部分,包括癌细胞表面受体及其复合物上的小分子结合位点,从而提供了一个较大的药物可靶向的空间,该空间只有小分子才能进入 。因此,小分子可以作为包括抗体在内的天然识别库的补充。然而,与抗体相比,小分子在癌症免疫治疗中具有不合适的药代动力学和药效学特性。人们试图利用各种化学编程抗体、化学编程双特异性抗体以及相关概念解决这些缺点,而且也有人报道了能够赋予小分子 募和激活CAR-T细胞能力的方法。

图1.cp-Fab系统的设计和概念。图片来自Angewandte Chemie, 2020, doi:10.1002/anie.202005432。
在利用常规的抗体Fab片段控制的开关型CAR-T细胞平台的基础上,来自美国国家癌症研究所、斯克里普斯研究所和德国维尔茨堡大学医院的研究人员将这种平台调整为由化学编程Fab(chemically programmed Fab, cp-Fab)控制。这有效地将对T细胞招募和激活的控制转 移到靶向癌细胞表面受体的小分子上。cp-Fab是在体外组装的,可用于在体外或体内激活CAR-T细胞。这种cp-Fab/CAR-T系统具有高度的通用性,唯一可变的成分是小分子,因此能够广泛地利用CAR-T细胞的力量探究细胞表面大分子的结合位点。相关研究结果近期发表在 Angewandte Chemie期刊上,论文标题为“Chemically Programmable and Switchable CAR‐T Therapy”。
为了对cp-Fab/CAR-T系统进行概念验证,这些作者着重关注靶向叶酸受体1(FOLR1)的叶酸结合位点。FOLR1是一种糖基磷脂酰肌醇(GPI)锚定的糖蛋白,它以纳摩尔的亲和力结合叶酸,从而促进受体介导的内吞作用。快速生长的实体恶性肿瘤,包括卵巢癌和肺癌,都 依赖于叶酸进行代谢和核酸合成。为了与健康细胞和组织竞争叶酸,FOLR1在这些癌症中高度过度表达。这使得FOLR1成为基于小分子和抗体的诊断和治疗试剂---包括CAR-T细胞和携带双特异性抗体的化学编程T细胞---的一个有吸引力的靶点。靶向FOLR1的常规CAR-T细胞 也有报道,并已转化为用于卵巢癌治疗的I期临床试验。在之前的这些研究的基础上,这些作者选择探索FOLR1的叶酸结合位点作为cp-Fab/CAR-T的代表性靶点。
2.IJC:新研究指出制造CAR-T细胞产品的成本可大幅降低
doi:10.1002/ijc.33156
嵌合抗原受体(CAR)T细胞(CAR-T)疗法是一种新的、在某些情况下非常有效的免疫疗法,可用于治疗某些类型的血液癌症和淋巴系统癌症。然而,这种有前途的治疗方法是有成本的。制造商为单个患者制造CAR-T细胞的收费高达32万欧元。在一项新的研究中,通过确 定所涉及的固定成本和可变成本,来自德国癌症研究中心(DKFZ)的研究人员确定,这类细胞免疫疗法可以在DKFZ这样的科研机构生产,而成本只有十分之一左右。相关研究结果于2020年6月14日在线发表在International Journal of Cancer期刊上,论文标题为“Cost of decentralized CAR T cell production in an academic non‐profit setting”。
两种商业化的CAR-T细胞产品已被批准用于治疗急性淋巴细胞T细胞白血病和非霍奇金淋巴瘤,如弥漫性大细胞B细胞淋巴瘤。只有在其他治疗方案失败的情况下才会使用它们。这种治疗方法通常是有效的:治疗两年后,40%~60%的患者没有复发。
然而,这种有前途的、高度个体化的治疗是有成本的:在德国,制造商为每名患者生产CAR-T细胞的费用高达32万欧元。DKFZ卫生经济学家Michael Schlander解释说,“CAR-T细胞疗法仍然只在少数癌症患者中可行,不过这种疗法将有望能够推广到其他类型的癌症。人们 相当担心我们的医疗系统将无法支付患者人数可能增加而带来的费用增加。”
3.Science子刊:利用表达FOXP3蛋白的TCR-T细胞治疗1型糖尿病已接近临床
doi:10.1126/scitranslmed.aay6422
在一项新的研究中,Rawlings及其研究团队与贝纳罗亚研究所主席Jane Buckner博士着重关注T细胞,即免疫系统中抗击疾病的白细胞。相关研究结果发表在2020年6月3日的Science Translational Medicine期刊上,论文标题为“Gene editing to induce FOXP3 expression in human CD4+ T cells leads to a stable regulatory phenotype and function”。
在1型糖尿病中,称为效应T细胞的特定类型免疫细胞会错误地攻击胰腺中产生胰岛素的胰岛细胞。这些胰岛细胞的职责是感知血液中葡萄糖水平上升,并通过释放胰岛素作出反应。由于免疫系统的其他组成部分---调节性T细胞(Treg)---不能正常发挥作用,所以这种攻 击仍在继续。

图片来自Science Translational Medicine, 2020, doi:10.1126/scitranslmed.aay6422。
为了阻止这种攻击,Rawlings实验室设计了一种方法:对患者自身的T细胞进行基因改造,使得它们像正常的Treg细胞一样发挥作用。他们希望当移植回患者体内时,这些经过基因改造或者说基因编辑的调节样T细胞(edited regulatory-like T cell, edTreg)进入胰腺 ,在那里它们可以帮助抑制过度活跃的免疫反应,从而维持和保护这些胰岛细胞的功能。
这篇论文展示了这些研究人员是如何利用基因编辑技术来靶向人T细胞中的FOXP3基因的。通过激活FOXP3,他们为T细胞提供了形成Treg细胞所需的指令。
由此产生的edTreg细胞看起来与天然Treg细胞非常相似。当在动物模型和组织培养物中进行测试时,它们的功能也像天然Treg细胞。最后,这些研究人员展示了他们如何让这些经过基因改造的细胞具有抗原特异性。根据Rawlings的说法,这一功能是通过将T细胞受体 (TCR)附着在这些经过基因改造的细胞的表面上来实现的,这对于将这些细胞引导到糖尿病患者的胰腺中将是至关重要的。
进一步验证这些结果的研究将有助于为针对1型糖尿病细胞疗法的I期临床试验铺平道路。他说,“这些数据首次证实通过激活FOXP3的方式进行基因改造足以制造出功能性的edTreg细胞。这不仅是一个里程碑式的研究发现,而且可以直接转化为临床使用。”
4.Nature重大突破!用CAR-T细胞治疗衰老!
doi:10.1038/s41586-020-2403-9
衰老是细胞老化的一个标志,并导致许多疾病。一种使免疫细胞靶向衰老细胞的新方法可能提供更好的治疗选择。衰老是细胞应激反应的一种形式。在某些情况下,它可能是有害的,人们正在努力开发针对衰老细胞的疗法。在《自然》(Nature)杂志上,Amor等人描述 了一种选择性去除小鼠衰老细胞的方法。
作者采用了一种目前用于抗癌治疗的技术。在这种疗法中,T细胞从个体中移除,在回输之前,对其进行操作,以增强其针对癌细胞的能力。这种细胞被称为CAR T细胞,因为它们被设计成表达所谓的嵌合抗原受体(CAR)。CAR的设计目的是识别并结合存在于癌细胞表面的 一种称为抗原的蛋白质的特定片段。如果这种相互作用发生,T细胞就会被激活并杀死肿瘤细胞。识别只在肿瘤细胞上表达的抗原是一个关键的挑战,因为CAR T细胞杀死健康细胞可能导致严重的副作用。
为了找到针对衰老细胞的抗原,Amor和同事分析了衰老的人和小鼠细胞中发现的跨膜蛋白的表达。八个最有希望的候选之一是尿激酶型纤溶酶原激活受体(uPAR)。对先前发表的关于人类组织中蛋白和RNA表达的数据进行的检查显示,uPAR要么未被检测到,要么在人体的大 部分器官(包括中枢神经系统、心脏和肝脏)中以低水平存在。然而,Amor和同事发现uPAR在体内和体外衰老细胞中都有高表达。有趣的是,缺乏跨膜区域的一种可溶性uPAR (suPAR)是SASP反应期间分泌的一种成分。suPAR的存在是一些慢性疾病的标志,包括糖尿病和肾病 ,衰老在这些疾病中起作用。
在确定uPAR作为衰老细胞的普遍标志后,Amor和他的同事设计了靶向uPAR的CAR T细胞。鉴于癌变前的细胞(那些可能在成为癌细胞)出现衰老以及很多抗癌治疗导致肿瘤细胞进入衰老来阻止他们的分裂,作者调查了这些CAR T细胞是否可以有效治疗癌症。他们报告说,以 uPAR为靶点的CAR T细胞治疗可以消除小鼠肝癌和肺癌模型中衰老的前恶性和恶性细胞。已经有人提出,通过后续针对衰老细胞的治疗,抗癌疗法可能会得到改善。Amor和他的同事在小鼠身上的研究证实了这种使用具有senolytic CAR T细胞的方法提高了抗癌治疗的有效 性。
使用senolytic CAR - T细胞的部分吸引力在于其治疗衰老涉及的许多疾病的潜力。事实上,Amor和他的同事证明,如果小鼠接受senolytic CAR T细胞治疗,可以改善非酒精性脂肪性肝炎(一种严重的脂肪肝)动物模型的肝纤维化结果。
5.I期临床试验表明靶向MAGE-A4的TCR-T细胞有望治疗多种实体瘤
新闻来源:Adoptive T-cell therapy ADP-A2M4 targeting MAGE-A4 shows early activity in patients with advanced solid tumors
过继性T细胞疗法ADP-A2M4涉及对来患者体内的T细胞进行基因改造使之表达可识别癌症抗原MAGE-A4的T细胞受体(TCR)。在美国德克萨斯大学MD安德森癌症中心的研究人员的领导下,针对ADP-A2M4的一项I期临床试验在包括滑膜肉瘤、头颈癌和肺癌在内的多种实体瘤的 患者中获得了反应。这项林场试验获得Adaptimmune公司的资助。

来自健康供者免疫系统的人T细胞的扫描电镜图,图片来自NIAID。
在38名接受这种治疗的患者中,ADP-A2M4 T细胞使得9人(23.7%)获得了总体反应(OR)或者说肿瘤缩小,18人(47.4%)病情稳定。在2020年美国临床肿瘤学会年会上,主要研究者、研究性癌症治疗学教授David Hong博士在口头报告中分享这项临床试验的数据。
Hong说,“到目前为止,我们还没有看到用现有的细胞疗法在治疗实体瘤上取得较强的反应,这在很大程度上是因为表达的抗原不限于肿瘤。在这项临床试验中,我很受鼓舞地看到一些患者出现了持久的反应,这些结果表明这种基于TCR-T细胞的新兴技术在治疗实体瘤方 面有潜力。”
6.BMJ子刊:体内研究证实靶向CD123的CAR-T细胞强烈抑制正常的造血功能
doi:10.1136/jitc-2020-000845
近年来,基于CAR-T细胞的细胞免疫疗法在癌症治疗中引发了前所未有的期待。CAR-T细胞免疫疗法涉及对人T细胞进行改造使之表达嵌合抗原受体(CAR),从而引导这些T细胞靶向位于癌细胞表面的肿瘤抗原。由于CAR-T细胞的高疗效、特异性和持久性,它们在B细胞恶性 肿瘤患者中表现出稳健的临床反应。
AML患者面临挑战的原因在于缺乏通用的AML靶抗原来引导CAR-T细胞,以及与健康的造血干细胞/祖细胞(HSPC)具有相同的靶抗原表达,这可能导致危及生命的脱靶细胞毒性。尽管如此,过去的研究已发现利用CD33和CD123重定向的CAR-T细胞治疗AML表现出强劲的抗白血 病活性,并处于临床前和临床开发的后期。
在这些CAR-T细胞是否具有骨髓清除性方面,它们在临床前和临床上产生了一些争议,这是因为它们也可能靶向健康的HSPC,毕竟HSPC是造血或者说血细胞生成所必需的。人们猜测HSPC也在不同程度上表达这些抗原,因此这些CAR-T细胞也可以攻击它们。 西班牙约瑟普-卡雷拉斯白血病研究所干细胞生物学、发育白血病与免疫治疗研究组的研究员Matteo Baroni和及其同事门猜测CAR-T细胞对健康HSPC作用的时间可能比对白血病细胞作用的时间要长。他们认为,之前关于靶向CD123的T细胞的潜在骨髓毒性的研究提供的结果 低估了这些CAR-T细胞的脱靶毒性潜力。
Baroni和他的团队在为期6周的体内研究中提供了大量的证据表明靶向CD123的CAR-T细胞的存在强烈抑制了正常的造血功能,从而造成新血细胞形成的不可逆障碍。相关研究结果于2020年6月10日在线发表在Journal for Immunotherapy of Cancer期刊上,论文标题 为“41BB-based and CD28-based CD123-redirected T-cells ablate human normal hematopoiesis in vivo”。
Baroni声称,“我们呼吁,对于那些经历难治性疾病复发且不能进一步从标准化疗中获益的AML患者,在异体移植之前谨慎使用靶向CD123的CAR-T细胞。对于这些患者来说,存在一个较好的替代选择。这些结果将帮助临床医生考虑靶向CD123的CAR-T细胞持续存在的关键长 期影响,并防止它们用于其他用途。”
7.新研究发现在CAR-T细胞免疫治疗后一个月内感染风险上升
doi:10.1093/ofid/ofaa121
根据一项新的研究,对于接受CD19嵌合抗原受体 (CAR) T细胞(CAR-T)输注的儿童和青少年来说,感染率在治疗后的第一个月增加,然后减少。相关研究结果近期发表在Open Forum Infectious Diseases期刊上,论文标题为“Infectious Complications Following CD19 Chimeric Antigen Receptor T-cell Therapy for Children, Adolescents, and Young Adults”。
美国华盛顿大学西雅图分校的Surabhi B. Vora博士及其同事们回顾了2014年至2017年期间在单一机构接受CD19 CAR-T细胞治疗的83名不大于26岁的患者的医疗记录。他们计算了在治疗前90天、治疗后0~28天和治疗后29~90天的每100天有感染风险的人数。
这些研究人员发现,98%的患者有难治性或复发性的急性淋巴细胞白血病。在治疗前90天内,54%的患者发生感染(感染密度,1.23),而在治疗后28天内,40%的患者发生感染(感染密度,2.89)。在治疗后的29~90天,感染密度降至0.55。大多数感染为细菌性感染或呼 吸道病毒感染(分别为39%和43%)。之前的造血细胞移植,免疫球蛋白G(IgG)水平<400 mg/dL,以及除环磷酰胺(cyclophosphamide)和氟达拉滨(fludarabine)以外的淋巴细胞清除(lymphodepletion)是治疗前与感染相关的危险因素;更严重的细胞因子释放综合 征和IgG<400 mg/dL是治疗后与感染相关的危险因素。
8.Cell Stem Cell:靶向CD133的CAR-T细胞有望治疗胶质母细胞瘤
doi:10.1016/j.stem.2020.04.008
在一项新的研究中,来自加拿大麦克马斯特大学和多伦多大学的研究人员开发出一种很有前景的免疫疗法,可用于治疗一种致命的成人脑癌形式,即胶质母细胞瘤(glioblastoma)。相关研究结果于2020年5月27日在线发表在Cell Stem Cell期刊上,论文标题为“The Rational Development of CD133-Targeting Immunotherapies for Glioblastoma”。

图片来自Cell Stem Cell, 2020, doi:10.1016/j.stem.2020.04.008。
这种称为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的免疫疗法涉及在实验室中对来自患者血液的T细胞进行基因改造,使得它们直接靶向结合胶质母细胞瘤细胞表面上的一种称为CD133的特定蛋白,并消灭这些癌细胞。
当在携带人类胶质母细胞瘤的小鼠身上使用时,靶向CD133的CAR-T细胞疗法被认为是成功的,这是因为它减少了这些小鼠的肿瘤负担,提高了它们的生存率。
来自这项研究的数据促使在加拿大汉密尔顿市成立了一家名为Empirica Therapeutics的脑癌免疫治疗公司。该公司的目标是在2022年之前,针对CD133特异性的CAR-T细胞疗法和其他疗法在复发性胶质母细胞瘤患者中进行临床试验。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


