膀胱癌免疫治疗!默克/辉瑞抗PD-L1疗法Bavencio一线维持治疗适应症在美日欧进入审查!
来源:本站原创 2020-06-23 16:27
Bavencio是第一个在III期试验中一线治疗UC显示出总生存期(OS)疗效优于标准护理的免疫疗法。

2020年06月23日讯 /生物谷BIOON/ --辉瑞(Pfizer)与合作伙伴默克(Merck KGaA)近日联合宣布,欧洲药品管理局(EMA)已受理抗PD-L1疗法Bavencio(avelumab)的一份II类变更申请:一线维持治疗局部晚期或转移性尿路上皮癌(UC)患者。现在,EMA已启动了审查程序。
今年早些时候,美国食品和药物管理局(FDA)受理了Bavencio上述适应症的补充生物制品许可申请(sBLA),该sBLA正在通过实时肿瘤学审查(RTOR)试点项目进行优先审查。之前,FDA还授予了Bavencio治疗上述适应症的突破性药物资格(BTD)。此外,日本厚生劳动省(MHLW)也已受理Bavencio上述适应症的补充新药申请(sNDA)。
此次申请基于III期JAVELIN Bladder 100研究(NCT02603432)的结果。数据显示,研究达到了主要终点:与最佳支持护理(BSC)治疗组相比,Bavencio联合BSC治疗组总生存期(OS)显示出统计学意义的显著改善。该研究数据已在ASCO2020虚拟科学会议上公布。值得一提的是,JAVELIN Bladder 100研究标志着III期试验中第一次有一种免疫疗法在一线治疗局部晚期或转移性UC方面显示出OS数据优于标准护理。
Bavencio是由辉瑞和默克合作开发的一款免疫肿瘤学药物,于2017年5月获得美国FDA加速批准,治疗局部晚期或转移性尿路上皮癌(mUC)患者,具体为:(1)含铂化疗期间或化疗后病情进展的患者;(2)手术前(新辅助治疗)或手术后(辅助治疗)接受含铂化疗12个月内病情进展的患者。该批准基于肿瘤缓解数据和缓解持续时间。
JAVELIN Bladder 100研究是一项验证性III期研究,旨在支持将Bavencio治疗UC适应症由加速批准转为完全批准。
膀胱癌(图片来源-medscape.com)
JAVELIN Bladder 100是一项多中心、多国、随机、开放标签、平行组研究,在完成一线含铂化疗后病情没有进展的局部晚期或转移性UC患者中开展,评估了Bavencio联合最佳支持护理(BSC)与单用BSC用于一线维持治疗的疗效和安全性。研究中,共有700例在诱导化疗后病情没有进展(根据RECIST v1.1评价)的患者,被随机分配进入Bavencio+BSC治疗组或BSC治疗组。主要终点是所有随机化患者和PD-L1阳性肿瘤患者中的总生存期(OS)。
该研究中,BSC将由治疗医生酌情实施,可以包括抗生素治疗、营养支持、代谢紊乱纠正、优化症状控制和疼痛管理(包括姑息放疗)等。BSC不包括任何积极的抗肿瘤治疗,但股息局部放射治疗孤立性病灶是可以接受的。
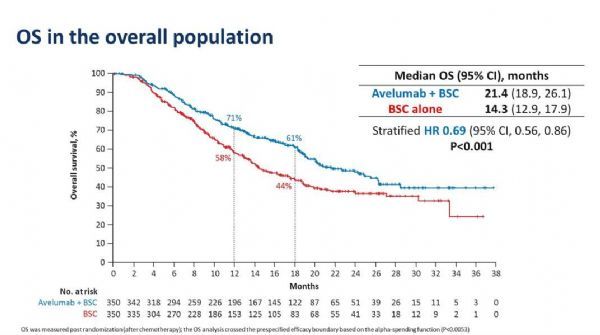
结果显示,在中期分析时,研究已达到OS主要终点:在2个共同主要群体(全部随机化患者,PD-L1阳性肿瘤患者)中,与BSC相比,Bavencio+BSC使OS取得了统计学意义的显著改善。具体数据为:在所有随机化患者中,与BSC组相比,Bavencio+BSC组中位OS显著延长(21.4个月 vs 14.3个月)、死亡风险降低31%(HR=0.69;95%CI:0.56-0.86;p<0.001)、12个月生存率(71% vs 58%)和18个月生存率(61% vs 44%)大幅提高。在PD-L1阳性肿瘤患者中,与BSC相比,Bavencio+BSC显示出更大的OS益处、将死亡风险降低幅度达44%。该研究中,Bavencio的安全性与JAVELIN单药临床开发项目中一致。
根据该研究,Bavencio是第一个在临床试验中一线治疗晚期UC使OS取得统计学意义显著改善的免疫疗法。过去30年来,化疗一直是晚期尿路上皮癌患者的一线护理标准。虽然这对许多患者来说是一个有效的短期选择,但大多数患者最终将经历疾病进展,这强调了需要更多的治疗选择。根据JAVENLIN Bladder 100研究的积极总生存期(OS)结果,Bavencio有潜力改变临床实践。
在全球范围内,膀胱癌是第十大常见癌症。在2018年,新确诊的膀胱癌病例超过50万,全球约20万人死于膀胱癌。尿路上皮癌(UC)约占膀胱癌的90%。当膀胱癌转移时,5年生存率仅为5%。联合化疗是目前治疗晚期疾病的一线标准,尽管初始缓解率很高,但一线化疗后持续和完全缓解并不常见,大多数患者在开始治疗后9个月内最终会出现疾病进展。考虑到晚期膀胱癌患者在一线化疗后病情不良进展,因此迫切需要额外的治疗方案,来改善总生存期。
Bavencio属于PD-(L)1肿瘤免疫疗法,这是当前备受瞩目的一类肿瘤免疫疗法,旨在利用人体自身的免疫系统抵御癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力。Bavencio在临床前模型中已被证明可以同时参与适应性免疫和先天性免疫功能。Bavencio通过阻断PD-L1与PD-1受体的相互作用,已被证明在临床前模型中释放了对T细胞介导的抗肿瘤免疫应答的抑制作用。
辉瑞于2014年11月与默克签署高达28.5亿美元协议,进军PD-(L)1领域。目前,双方正在推进JAVELIN临床开发项目,该项目涉及超过15种不同类型肿瘤、1万多例患者。除了胃/胃食管交界腺癌之外,这些肿瘤类型还包括:卵巢癌、乳腺癌、头颈癌、默克尔细胞癌、非小细胞肺癌、肾细胞癌和尿路上皮癌等。
在美国,Bavencio于2017年3月获FDA加速批准,用于治疗12岁及以上儿科和成人转移性默克尔细胞癌(mMCC)的治疗,此次批准使该药成为全球首个治疗mMCC的肿瘤免疫疗法,这是一种比黑色素瘤预后更差的侵袭性皮肤癌。2017年5月,Bavencio再获美国FDA加速批准,用于:(1)含铂化疗期间或化疗后病情进展的局部晚期或转移性尿路上皮癌(mUC)患者;(2)手术前(新辅助治疗)或手术后(辅助治疗)接受含铂化疗12个月内病情进展的局部晚期或转移性尿路上皮癌(mUC)患者。2019年5月,Bavencio与酪氨酸激酶抑制剂Inlyta(axitinib,阿昔替尼)联合治疗方案获FDA批准,一线治疗晚期肾细胞癌(RCC)患者。(生物谷Bioon.com)
原文出处:European Medicines Agency Validates application for BAVENCIO® (avelumab) for First-Line Maintenance Treatment of Locally Advanced or Metastatic Urothelial Carcinoma
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->