Science展望:COVID-19药物的快速再利用
来源:本站原创 2020-06-02 08:59
2020年6月2日讯 /生物谷BIOON /——2019年出现了新型急性呼吸道疾病2019冠状病毒病(COVID-19)。COVID-19是由严重急性呼吸道综合征2型冠状病毒(SARS-CoV-2)引起的。COVID-19已被世界卫生组织宣布为大流行,并继续在全球传播。大多数患者在1至3周内康复。然而,一小部分人(?5%)会发展成严重的疾病,进而发展成急性呼
2020年6月2日讯 /生物谷BIOON /——2019年出现了新型急性呼吸道疾病2019冠状病毒病(COVID-19)。COVID-19是由严重急性呼吸道综合征2型冠状病毒(SARS-CoV-2)引起的。COVID-19已被世界卫生组织宣布为大流行,并继续在全球传播。大多数患者在1至3周内康复。然而,一小部分人(?5%)会发展成严重的疾病,进而发展成急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS),进而导致死亡。目前,只有支持性护理可用;患者将大大受益于可用的直接治疗方法。确定治疗方法的一种方法是将已批准的药物用于其他用途,利用现有的人类药理学和毒理学的详细信息,使快速临床试验和监管审查成为可能。
冠状病毒是感染脊椎动物并在不同宿主物种间传播的单链RNA病毒。随着SARS-CoV-2的出现,现在已知有7种冠状病毒可以感染人类。其中四种病毒(HCoV-229E、HCoV-OC43、HCoV-NL63和HCoV-HKU1)导致人类约30%的普通感冒病例。其中两个导致了最近的流行病,与死亡率有相当大的相关性:SARS-CoV-1,它出现在2002-2003年,导致死亡率为?10%;中东呼吸综合征冠状病毒(MERS-CoV),出现在2012年,仍然活跃,导致?35%的死亡率。与COVID-19相比,这两种流行病只影响了相对较少的患者。COVID-19的传染性更强,原因包括无症状携带者、潜伏期长和传染性高。在COVID-19之前,只有SARS-CoV-1和MERS-CoV引起严重疾病。因此相对于其他病毒性疾病,如流感,冠状病毒药物的开发相对较少。鉴于COVID-19的迅速传播及其相对较高的死亡率,填补冠状病毒特异性药物的空白迫在眉睫。
冠状病毒生命周期涉及大量的潜在通路的步骤,包括进入宿主细胞的内吞作用(涉及血管紧张素转换酶2 (ACE2)和跨膜蛋白酶丝氨酸(TMPRSS2)]、RNA复制和转录(涉及解旋酶和依赖RNA的RNA聚合酶(RdRp)]、翻译和蛋白水解处理过程(涉及胰凝乳蛋白酶样和木瓜蛋白酶样蛋白酶)、病毒粒子的组装以及新病毒的释放过程等。除了病毒编码的靶点外,许多宿主靶点对于病毒复制和疾病进展都是必不可少的。
SARS-CoV-2的细胞受体是ACE2。重组人ACE2 (rhACE2,或APN01)目前正在开发中,用于治疗急性肺损伤和肺动脉高压,并在健康志愿者的一期试验中证明了良好的耐受性。rhACE2已被证明可以显着减少病毒进入人类细胞衍生的器官,可能是作为病毒结合的诱饵。这为正在调查用APN01阻断病毒进入COVID-19患者的临床试验提供了支持。成功的病毒进入需要蛋白水解处理病毒的刺突糖蛋白(S蛋白),可由TMPRSS2进行。TMPRSS2抑制剂卡莫司他(camostat)在日本被批准用于治疗慢性胰腺炎术后胃返流,一般耐受性良好,偶见罕见的严重副作用。卡莫司他和相关的萘莫司他(nafamostat)都可以阻止在表达TMPRSS2的人类细胞中SARS-CoV-2的复制。卡莫司他已被证明可以在小鼠模型中阻断SARS-CoV-2感染。因此,有充分的理由支持这些药物用于COVID-19的临床试验,这些试验已经在荷兰和德国启动。
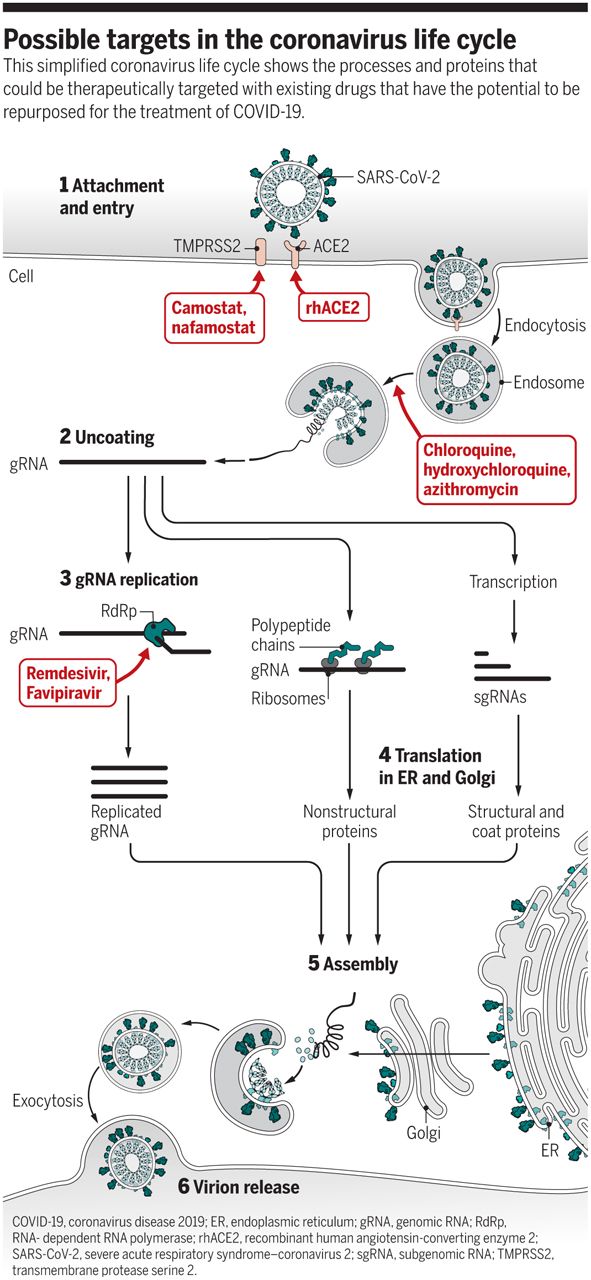
图片来源:Science
冠状病毒利用内溶酶体途径在脱壳前进入细胞。氯喹(CQ)和羟基氯喹(HCQ)是影响体内功能和阻断自噬体-溶酶体融合的抗疟药物。这两种药物已被证明可以在细胞模型中抑制SARS-CoV-2复制。阿奇霉素(Azithromycin, AZ)是一种广泛使用的广谱抗生素,它还能阻止自噬小体在人类细胞中的清除以及寨卡病毒和流感病毒在体外在人类细胞中的复制。COVID-19患者HCQ小范围随机试验的初步结果显示,病人恢复的时间缩短了。一项小型的开放标签试验表明,与单独接受HCQ和AZ联合治疗的COVID-19患者相比,HCQ和AZ联合治疗的患者的病毒载量降低了,尽管这项研究由于从研究分析中剔除了几个受试者而受到严厉批评。这些产生假设的研究已经证明,在美国紧急批准使用它们治疗COVID-19是合理的,这两种药物在美国都被广泛使用。
然而,HCQ和AZ都有潜在的心脏毒性(QT延长,可导致致命的心律失常),而且HCQ对眼睛也有潜在的负面影响。如果这些药物要成为治疗COVID-19的标准,了解风险-效益比是至关重要的。在美国和欧洲进行的几项事后分析表明,对COVID-19患者进行HCQ单药治疗最多只能获得有限的益处;一项针对美国退伍军人的大型事后分析显示,HCQ对病人有伤害。鉴于这一机制的基本原理,但缺乏设计良好的临床研究和药物诱导毒性的潜力,有必要进行对照、随机试验,以测试这些药物对COVID-19患者的疗效和安全性。
脱壳后,病毒基因组RNA被用于帽子依赖的翻译产生两个多肽,然后自蛋白水解加工产生几种病毒蛋白,包括RdRp和两个蛋白酶。虽然蛋白酶可能看起来是有吸引力的目标,但是它们和其他病毒蛋白酶的关系较远。HIV蛋白酶抑制剂洛匹那韦和利托那韦的联合使用在COVID-19患者中被证明是无效的,与之前在SARS-CoV-1疾病中相同的联合使用情况相同。因此,进一步利用这类药物是不合理的--尽管在早期药物开发中有其他针对冠状病毒蛋白酶的蛋白酶抑制剂。
复制复合体蛋白的产生,包括解旋酶和RdRp,允许病毒的基因组复制和亚基因组RNA的产生,亚基因组RNA也被翻译生成结构蛋白和外壳蛋白。解旋酶在理论上是一个有吸引力的靶点,但它与其他病毒解旋酶不同,而且没有证据表明单纯疱疹病毒解旋酶抑制剂amenamevir或pretelivir对冠状病毒有效。
RdRp同时进行病毒RNA的复制和转录,使其成为阻断病毒生命周期的明确靶点。由于RdRp是许多病毒的关键蛋白,一些广谱RdRp抑制剂或已获批准或正在临床试验,包括瑞德西韦和favipiravir。瑞德西韦最初用于治疗引起埃博拉和马尔堡病毒的黄病毒,并在过去两次埃博拉疫情的试验中被证明是安全的。然而,它对埃博拉病毒的效果不如基于抗体的治疗方法,后者可以防止病毒进入人体细胞。随后,在动物模型中,瑞德西韦被证明对SARS-CoV-1和MERS-CoV都有活性。Favipiravir是针对流感研发的,并于2014年在日本获得批准,特别是针对新的大流行性流感爆发。在人体细胞上进行的体外实验中,瑞德西韦和favipiravir都对SARS-CoV-2有效。瑞德西韦一直在几项COVID-19临床实验中快速推进,目前的临床数据表明这种药物对COVID-19患者是安全有效的。但是进一步使用RdRp抑制剂的随机、对照试验是合理和必要的。
用于治疗COVID-19患者的最合理的药物是针对宿主因子的药物HCQ、AZ、camostat和nafamostat,以及针对RdRp的病毒药物瑞德西韦和favipiravir。一些其他药物也在考虑之中,虽然证据较少。(生物谷Bioon.com)
参考资料:
【1】Rapid repurposing of drugs for COVID-19. Science 08 May 2020: eabb9332 DOI: 10.1126/science.abb9332
【2】T. S. Fung, D. X. Liu, Human Coronavirus: Host-Pathogen Interaction. Annu. Rev. Microbiol. 73, 529 (2019).
【3】G. Li, E. De Clercq, Therapeutic Options for the 2019 Novel Coronavirus (2019-nCoV). Nat. Rev. Drug Discov. 19, 149 (2020).
【4】D. H. Tran et al., Azithromycin, a 15-membered Macrolide Antibiotic, Inhibits Influenza A(H1N1)pdm09 Virus Infection by Interfering With Virus Internalization Process. J. Antibiot. 72, 759 (2019).
【5】M. Renna et al., Azithromycin Blocks Autophagy and May Predispose Cystic Fibrosis Patients to Mycobacterial Infection. J. Clin. Invest. 121, 3554 (2011).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


