国产BTK抑制剂「泽布替尼」即将获批上市
来源:新浪医药新闻 2020-05-29 12:41
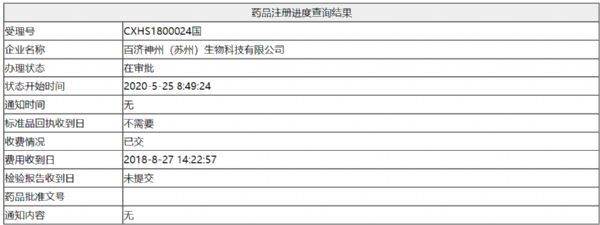
5月26日,国家药监局网站更新了百济神州BTK抑制剂泽布替尼(zanubrutinib)的办理状态(受理号:CXHS1800024、CXHS1800030),变为“在审批”。据悉,这两个受理号相应的适应症分别为:复发/难治性套细胞淋巴瘤(R/R MCL)、复发性难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)。两个受理号的办理状态同时
5月26日,国家药监局网站更新了百济神州BTK抑制剂泽布替尼(zanubrutinib)的办理状态(受理号:CXHS1800024、CXHS1800030),变为“在审批”。据悉,这两个受理号相应的适应症分别为:复发/难治性套细胞淋巴瘤(R/R MCL)、复发性难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)。
两个受理号的办理状态同时更新,预示着泽布替尼在国内有望同时获批上述两个适应症。
泽布替尼是百济神州自主开发的一款旨在最大化布鲁顿酪氨酸激酶(BTK)占有率、最小化脱靶效应的小分子抑制剂,2019年11月,获得美国FDA加速批准用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤(MCL)患者,成为第一个在美获批上市的中国本土自主研发抗癌新药。
遗憾的是,2020年第一季度,泽布替尼在美国的产品收入仅为72万美元。随着适应症的拓展,以及在更多国家/地区获得监管许可,相信销售惨淡的局面很快就会逆转。
在一季度财报中,百济神州公布泽布替尼预计里程碑事件,除了将在中国获批用于治疗R/R MCL患者以及R/R CLL或SLL患者外,还包括:
最早于2020年下半年公布泽布替尼对比苯达莫司汀联合利妥昔单抗用于治疗初治CLL或SLL患者的SEQUOIA临床试验的主要数据;
于2020年在中国递交用于治疗华氏巨球蛋白血症患者(WM)患者的sNDA;
于2020年与美国FDA和欧洲EMA讨论泽布替尼对比伊布替尼用于治疗WM患者的ASPEN 3期临床试验(clinicaltrials.gov登记号:NCT03053440)数据;
于2020年完成泽布替尼对比伊布替尼用于治疗R/R CLL或SLL患者的3期临床试验(ALPINE ,clinicaltrials.gov登记号:NCT03734016)扩展后的患者入组。
在即将举办的ASCO 2020年会上,百济神州将以口头报告的形式公布泽布替尼对比伊布替尼用于治疗WM患者的3期随机临床试验结果(ASPEN),在一项海报中公布泽布替尼用于治疗初治和既往接受过治疗的WM患者的三年随访数据。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。