深度剖析!RNA修饰在癌症发生和进展过程中扮演的关键角色!
来源:本站原创 2020-05-27 15:03
2020年5月27日 讯 /生物谷BIOON/ --近日,一篇发表在国际杂志Nature Reviews Cancer上题为“Role of RNA modifications in cancer”的综述文章中,来自英国剑桥大学的科学家们论述了RNA修饰在癌症中扮演的关键角色。生物性分子的特定修饰是调节分子功能的有效方法,大量的下游信号通路会受到DNA和蛋白
2020年5月27日 讯 /生物谷BIOON/ --近日,一篇发表在国际杂志Nature Reviews Cancer上题为“Role of RNA modifications in cancer”的综述文章中,来自英国剑桥大学的科学家们论述了RNA修饰在癌症中扮演的关键角色。
生物性分子的特定修饰是调节分子功能的有效方法,大量的下游信号通路会受到DNA和蛋白质修饰的影响,很多负责调节蛋白质和DNA修饰的酶类都是当前癌症疗法的关键靶点,RNA的表观转录组学(即对RNA修饰的研究)就是一个新的研究领域;尽管真核生物的RNA修饰自20世纪70年代以来就已经被人们所熟知,但直到最近十年,研究者才发现,它们大多是在转移RNA和核糖体RNA上被识别和鉴定的,研究人员就能对所识别的mRNA和多种非编码RNA进行特性分析。
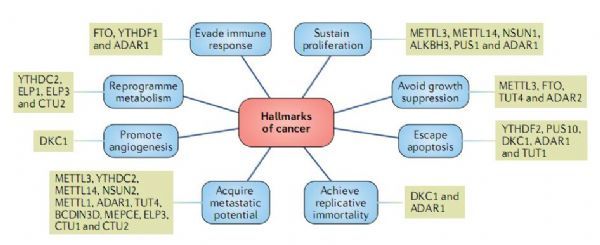
图片来源:Barbieri, I et al. Nat Rev Cancer doi:10.1038/s41568-020-0253-2
如今越来越多的证据表明,RNA的修饰通路在人类癌症中处于错误调节状态,因此其或许有望作为开发癌症疗法理想靶点,这篇综述报道中,研究者揭示了参与癌症发生的RNA表观转录组学通路,并描述了其生物学功能及其与疾病的关联。癌细胞拥有多种特征,这些特征往往会赋予其能无限生长并且躲避宿主机体的免疫监视,有8种不同的关键特征被定义为癌症的主要标志,上图揭示了RNA修饰写入器、读取器和擦除器如何对这些标志产生促进会抑制效应,如今研究人员越来越清楚,RNA修饰和负责沉积、清楚和检测的酶类在不同类型癌症中扮演着非常关键的角色。
在某些情况下,一种单一的酶类在不同癌症类型中往往扮演着相反的角色,考虑到RNA修饰的多样性及修饰RNA的种类,这或许并不足为奇;AML(急性髓性白血病)中m6A酶类的状况就显得有些奇怪,m6A写入器(METTL3–METTL14和METTL16)和m6A擦除器(FTO)或许就具有原始致癌特性,然而,这或许能被大量m6A修饰的mRNAs所解释,对于一些原始促癌的mRNAs而言,m6A对于维持高表达水平至关重要,相比之下,m6A的移除或许就是特定肿瘤抑制子mRNAs稳定所需要的。
大多数的RNA修饰分子的特征都是基于细胞自主标记的影响效应,比如促进癌细胞增殖或调解癌细胞的侵袭性和转移潜能等;尤其是,m6A分子和尿苷化酶类在细胞增殖、生长和转移潜能抑制上扮演着多种不同的角色,研究人员很容易调查癌细胞的这三种特点,但考虑到我们在这一研究领域尚处于最早期阶段,研究人员很有可能会发现新的非细胞自主的RNA修饰依赖性功能,比如,研究人员就非常感兴趣研究RNA修饰在血管生成、癌细胞和宿主免疫系统之间相互作用中所扮演的关键角色,对ADAR1和FTO在调节细胞和系统性免疫反应上的功能进行研究或能帮助研究人员利用这些酶类作为靶点来拓宽免疫疗法治疗癌症的效应。
最近,阐明细胞在癌变过程中所经历的代谢过程或许会成为理解癌症进展机制的一个核心方面,如今科学家们正在努力寻找靶向作用癌细胞代谢的新方法;然而研究人员并不清楚RNA修饰对癌症标志物的影响效应,但相关通路或能作为一种新方法来理解癌症代谢的建立和调节机制,相反,癌症特异性的代谢改变或许也会潜在直接影响RNA的修饰以及相关的基因表达。有相关研究表明,RNA修饰通路会通过调节HIF1A mRNA来调节细胞代谢,尤其是,m6A修饰的HIF1A能够被m6A修饰和YTHDC2的结合来稳定,同时U34摆动的tRNA修饰则能维持黑色素瘤细胞中高水平的HIF1α;RNA修饰酶类或许能作为特殊代谢产物的传感器,比如METTL16和FTO等,METTL16的活性对于SAM水平非常敏感,反过来其会通过修饰SAM合酶基因MAT2A20来调节SAM的合成,同样地,FTO对于α-酮戊二酸非常敏感,而且其还会被肿瘤代谢产物2-羟基谷氨酸所抑制。
图片来源:Barbieri, I et al. Nat Rev Cancer doi:10.1038/s41568-020-0253-2
对疗法的耐受性时目前癌症疗法开发过程所面临的挑战,最开始对特定抗癌药物产生反应的肿瘤随后会产生获得性耐药性并且导致肿瘤复发,比如治疗BRAFV600E驱动的黑色素瘤的BRAF抑制剂或许就是如此,在其它情况下,疗法往往仅能对一部分患者有效,而其余的肿瘤则会表现出原发性的耐药性,利用免疫疗法治疗黑色素瘤或许就是这种情况,尽管治疗效果较为显著,但仅有一半的肿瘤会对疗法产生反应。尽管RNA表观遗传学仍然是一个未被开发的领域,但多项研究表明,RNA修饰通路能够影响原发和获得性的药物耐受性,FTO能够保护黑色素瘤细胞免疫免疫疗法的作用,而其活性下调后则会增加癌细胞对抗PD1疗法的敏感性;类似地,ADAR1通常需要抑制衍生自内源性还原转座子的dsRNA,其就能被癌细胞用来躲避宿主机体的免疫反应;更为重要的是,ADAR1的抑制会增加黑色素瘤细胞对免疫疗法的敏感性,最后,U34摆动的tRNA修饰酶类的失活或会增加BRAF抑制剂治疗BRAFV600E驱动的黑色素瘤的敏感性,并能逆转癌细胞对BRAF抑制剂的获得性耐药性,相关研究结果就强调了开发靶向作用RNA表观遗传学特征的治疗性制剂从而增加当前抗癌疗法的重要性。
尽管多种RNA修饰主要存在于tRNA上,但相关酶类的遗传性抑制似乎能够特异性地影响癌细胞,但并不会损伤正常细胞的存活,这一点在对癌症中tRNA U34的修饰子中得到了很好的印证,tRNA的修饰通常存在于tRNAs的亚群中,而其缺失仅会影响编码转录物的亚群的翻译,这种特异性就表明,tRNA的修饰或许是一种相比以前认为地更受调控的现象,这些观察性研究结果也表明,靶向作用tRNA修饰子或许是未来抗癌疗法的一个可行性的选择。
许多将RNA表观转录组异常与癌症相关联的研究证据强烈表明,开发靶向作用RNA通路的抑制剂或许是一种富有成效的选择和追求,RNA修饰及参与RNA修饰的分子通路的多样性给研究人员以希望,当然了,这仅仅是RNA表观遗传学在癌症疗法中的开始。(生物谷Bioon.com)
参考资料:
Barbieri, I., Kouzarides, T. Role of RNA modifications in cancer. Nat Rev Cancer 20, 303–322 (2020). doi:10.1038/s41568-020-0253-2
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。