全球RET激酶抑制剂!礼来“不限癌种”靶向抗癌药Retevmo获美国FDA批准,治疗3类肿瘤!
来源:本站原创 2020-05-09 15:41
Retevmo是第一个被批准专门用于携带RET基因改变的癌症患者的治疗药物,此次批准包括:非小细胞肺癌、甲状腺髓样癌、其他类型甲状腺癌。

2020年05月09日讯 /生物谷BIOON/ --美国食品和药物管理局(FDA)近日批准礼来(Eli Lilly)子公司Loxo Oncology的靶向抗癌药Retevmo(selpercatinib,40mg和80mg胶囊),用于治疗肿瘤在特定基因(转染期间重排基因,RET基因)存在基因改变(突变或融合)的3种类型肿瘤患者:非小细胞肺癌(NSCLC)、甲状腺髓样癌(MTC)、其他类型的甲状腺癌。
Retevmo是第一个被批准专门用于携带RET基因改变的癌症患者的治疗药物。具体而言,该药被批准用于治疗:(1)晚期或转移性NSCLC成人患者;(2)年龄≥12岁、需要系统治疗的晚期或转移性MTC患者;(3)年龄≥12岁、需要系统治疗、对放射性碘治疗停止应答或不适合放射性碘治疗的晚期RET融合阳性甲状腺癌患者。特别值得一提的是,高达50%的RET融合阳性NSCLC患者可能存在肿瘤脑转移,在存在基线脑转移的患者中,Retevmo显示出强劲疗效,颅内缓解(CNS-ORR)高达91%(n=10/11)。
Retevmo是一种选择性RET激酶抑制剂,能够阻断RET激酶,并阻止癌细胞生长,该药也可能影响健康细胞,从而产生副作用。此次批准基于I/II期临床研究LIBRETTO-001的总缓解率(ORR)和缓解持续时间(DOR)数据,通过FDA的加速审批程序获得批准。这些适应症的持续批准将取决于验证性试验中临床益处的验证和描述。此前,FDA已授予Retevmo孤儿药资格(ODD)、突破性药物资格(BTD)、优先审查资格。
Retevmo是一种口服处方药,推荐剂量为120mg或160mg(根据体重而定),每日服用2次,直至疾病恶化或出现不可接受的毒性。需要指出的是,在启动Retevmo治疗之前,患者必须通过实验室检测确认肿瘤中存在RET基因改变。
FDA肿瘤卓越中心主任、FDA药物评价和研究中心肿瘤疾病办公室代理主任Richard Pazdur医学博士表示:“基因特异性疗法的创新继续以快速的步伐推进医学实践,并为以前很少有治疗方案的患者提供治疗选择。FDA致力于审查针对癌症患者特定亚群的治疗药物,例如Retevmo。”
此次批准,基于I/II期临床研究LIBRETTO-001的数据。该研究是评估一种RET抑制剂治疗存在RET改变癌症患者(包括NSCLC、MTC、其他类型的甲状腺癌)的最大规模临床研究。研究期间,患者每日2次口服160mg Retevmo,直至疾病恶化或出现不可接受的毒性。主要疗效指标为总缓解率(ORR)和缓解持续时间(DOR)。
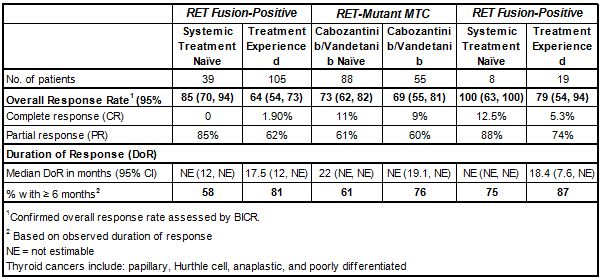
——治疗NSCLC:在105例先前接受过含铂化疗治疗(经治)、39例先前未接受过治疗(初治)RET融合阳性NSCLC成人患者中进行了疗效评价。结果显示,105例经治患者中,ORR为64%,81%的应答患者DOR≥6个月。39例初治患者中,ORR为84%,58%的应答患者DOR≥6个月。在11例存在基线脑转移的经治患者中,颅内缓解率(CNS-ORR)为91%(n=10/11),全部10例缓解患者的颅内缓解持续时间(CNS-DOR)≥6个月。
——治疗MTC:在143例晚期或转移性RET突变MTC患者(年龄≥12岁)中进行了疗效评价,其中55例先前接受过卡博替尼(cabozantinib)、凡德他尼(vandetanib)或2种药物治疗,88例先前未接受过卡博替尼或凡德他尼治疗。结果显示,在55例先前接受过治疗的患者中,ORR为69%,76%的应答患者DOR≥6个月。在88例先前没有接受过经批准的MTC疗法的患者中,ORR为73%、61%的应答患者DOR≥6个月。
——治疗RET融合阳性甲状腺癌:在27例RET融合甲状腺癌患者中进行了疗效评价,其中19例放射性碘(RAI,如果是一种合适的方案)难治并且接受过另一种系统疗法、8例RAI难治并且没有接受任何其他疗法。数据显示,在19例接受过另一种系统疗法的患者中,ORR为79%、87%的应答患者DOR≥6个月;在8例除RAI之外未接受过其他疗法的患者中,ORR为100%、75%的应答患者DOR≥6个月。
据估计,RET融合存在于大约2%的非小细胞肺癌(NSCLC)、10-20%的乳头状甲状腺癌(PTC)和其他类型甲状腺癌、以及其他癌症(如结直肠癌)亚组中;RET点突变存在于大约60%的甲状腺髓样癌(MTC)中。RET融合及RET点突变癌症主要依赖于RET激酶的激活来维持其增殖和存活,这种依赖性通常被称为“致癌基因成瘾”,使得这类肿瘤对靶向RET的小分子抑制剂高度敏感。
Retevmo是一种强效、口服、高度选择性、转染期间重排(RET)激酶抑制剂,用于治疗RET异常的癌症患者。RET基因是一个在转染过程中发生重排的原癌基因,并因此而得名,该基因编码一种细胞膜受体酪氨酸激酶,其异常是多种类型肿瘤的罕见驱动因素。Retevmo旨在抑制天然的RET信号转导以及预期的获得性耐药机制,开发用于治疗肿瘤中携带异常的RET激酶的患者。

在美国,FDA已授予selpercatinib治疗三类患者的突破性药物资格(BTD),具体为:(1)接受含铂化疗以及一种PD-1或PD-L1肿瘤免疫疗法治疗后病情进展、需要系统治疗(全身治疗)的转移性RET融合阳性NSCLC患者;(2)既往接受治疗后病情进展且没有可接受的替代治疗选择、需要系统治疗的RET突变型甲状腺髓样癌(MTC)患者;(3)既往接受其他方案后病情进展且没有可接受的替代治疗方案、需要系统治疗的晚期RET融合阳性甲状腺癌患者。
在2019年,FDA授予了selpercatinib孤儿药资格,用于治疗:RET融合阳性NSCLC、RET融合阳性和RET突变甲状腺癌,包括低分化甲状腺癌、未分化或间变性甲状腺癌、MTC、局部晚期或转移性滤泡或乳头状甲状腺癌。
selpercatinib是Loxo Oncology公司的药物,礼来在2019年1月以80亿美元将Loxo Oncology收购。2019年12月,礼来启动了selpercatinib的2项验证性III期试验:LIBRETTO-431试验用于治疗初治RET融合阳性NSCLC患者,LIBRETTO-531用于治疗初治RET突变MTC患者。每项试验将招募400例患者。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


