盘点:2020年1-4月美国FDA批准的创新疗法!
来源:本站原创 2020-04-30 23:59
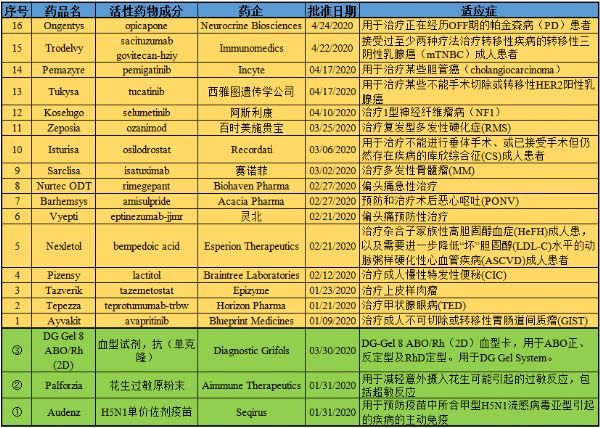
2020年04月30日讯 /生物谷BIOON/ --根据美国食品和药物管理局(FDA)药品评审与研究中心(CDER)的数据统计,在2020年1-4月,FDA批准了16款创新疗法。而根据FDA生物制剂评审与研究中心(CBER)的数据统计,在2020年1-4月,FDA还批准了一款食物过敏免疫疗法(Palforzia)、一款流感疫苗(Audenz)、一款ABO/R

2020年04月30日讯 /生物谷BIOON/ --根据美国食品和药物管理局(FDA)药品评审与研究中心(CDER)的数据统计,在2020年1-4月,FDA批准了16款创新疗法。而根据FDA生物制剂评审与研究中心(CBER)的数据统计,在2020年1-4月,FDA还批准了一款食物过敏免疫疗法(Palforzia)、一款流感疫苗(Audenz)、一款ABO/Rh血型卡(DG Gel 8 ABO/Rh (2D))。
每月末,生物谷医药板块小编会对统计表格进行更新,并对这些创新疗法进行盘点。(点击图片查看大图)
【备注】1-3月批准的创新药盘点,详见:【盘点】2020年第一季度美国FDA批准的创新疗法!
4月24日,FDA批准Neurocrine Biosciences药物Ongentys(opicapone)25mg和50mg胶囊,这是一种新型、每日一次、口服选择性儿茶酚-氧位-甲基转移酶(COMT)抑制剂,作为左旋多巴/卡比多巴的一种辅助疗法,用于正在经历运动波动(“OFF”期)的帕金森病(PD)患者。值得一提的是,Ongentys是第一个也是唯一一个被批准的每日一次COMT抑制剂,将提供一种新的治疗方案来延长左旋多巴/卡比多巴的疗效。
随着时间的推移,服用左旋多巴/卡比多巴的患者可能开始在2次治疗剂量之间经历“OFF”期,在此期间,帕金森病运动症状(如震颤、运动迟缓和行走困难)增加。临床数据显示,在正经历“OFF”期的帕金森病患者中,Ongentys加用左旋多巴/卡比多巴,可减少“OFF”期,同时增加“ON”期,并且不会出现令人烦恼的运动障碍。在“ON”期,帕金森病患者的运动症状得到更好的控制。值得一提的是,与安慰剂相比,服药后两小时内,Ongentys就能够显著减少患者的不自主运动时间和“OFF-ON(开关)现象”。
Ongentys是一种口服的选择性COMT抑制剂,有助于阻断分解左旋多巴的COMT酶,左旋多巴是控制帕金森病患者运动症状的金标准疗法。Ongentys通过减少左旋多巴在血液中的分解从而保护左旋多巴,使更多的左旋多巴可以到达大脑,延长其临床效果,帮助患者实现运动症状控制。
COMT抑制剂是目前欧美和国内治疗指南明确推荐的、辅助多巴胺治疗帕金森病患者的一线药物。Ongentys的活性药物成分opicapone由BIAL公司研发,这是一种新型的强效第三代COMT抑制剂,通过降低左旋多巴转化为3-O-甲基多巴的转化率来延长左旋多巴的临床疗效,从而提高大脑的利用率。
Neurocrine Biosciences公司在2017年从葡萄牙制药公司BIAL授权获得opicapone在美国和加拿大的独家开发和商业化权利。2018年1月,复星医药以1800万美元从BIAL公司授权获得了opicapone在中国市场的独家权利,其中包括一笔300万美元首付款和高达1500万美元的里程碑付款。2019年3月,CDE承办了复星医药的临床申请。
4月22日,FDA批准Immunomedics公司抗体药物偶联物(ADC)Trodelvy(sacituzumab govitecan-hziy),用于先前已接受过至少两种疗法治疗转移性疾病的转移性三阴性乳腺癌(mTNBC)成人患者。值得一提的是,Trodelvy是FDA批准的第一个专门治疗复发或难治性mTNBC的ADC药物,也是FDA批准的第一个抗Trop-2 ADC药物。
TNBC是一种预后很差的侵袭性癌症,除了传统化疗之外,治疗方案极其有限。Trodelvy有潜力成为TNBC治疗的一个标准护理药物。在临床试验中,Trodelvy在难治mTNBC患者中显示了临床意义上的缓解,该药将为临床医生提供一个新的工具,为mTNBC患者带来更好的治疗结局。在临床研究中,与标准护理相比,Trodelvy展现出强劲疗效,代表着mTNBC治疗方面的一个重大进步。之前,FDA授予了Trodelvy突破性药物资格(BTD)和优先审查。
Trodelvy的活性药物成分为sacituzumab govitecan,这是一种新型、首创的抗体药物偶联物(ADC)药物,由靶向TROP-2抗原的人源化IgG1抗体与化疗药物伊立替康(一种拓扑异构酶I抑制剂)的代谢活性产物SN-38偶联而成。TROP-2是一种在90%以上的TNBC中表达的细胞表面糖蛋白。
此次批准基于单臂多中心II期研究的数据。该研究中共入组了108例过度预治疗的mTNBC成人患者,这些患者先前接受过多种疗法(范围:2-10种)治疗转移性疾病。数据显示,Trodelvy治疗的客观缓解率(ORR)为33.3%(95%CI:24.6,43.1)、中位缓解持续时间(DOR)为7.7个月(95%CI:4.9,10.8)。
乳腺癌是女性中最常见的癌症类型,全球每年确诊超过200万例。三阴乳腺癌(TNBC)约占所有乳腺癌比例的15%,与其他类型乳腺癌相比,TNBC在50岁以下女性中更为常见。TNBC特指雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2(HER-2)三者均为阴性表达的乳腺癌,进展迅速,预后极差,5年生存率不到15%。TNBC对激素疗法和HER2靶向疗法(如罗氏赫赛汀Herceptin)均无效,临床治疗选择非常有限,主要依靠化疗。
TNBC治疗方面,值得一提的是,2019年3月罗氏PD-L1肿瘤免疫疗法Tecentriq获美国FDA批准,联合化疗(Abraxane)一线治疗PD-L1阳性局部晚期或转移性三阴性乳腺癌(TNBC)患者。此次批准,使Tecentriq+Abraxane组合成为治疗TNBC的首个癌症免疫治疗方案。
4月17日,FDA批准信达生物合作伙伴Incyte靶向抗癌药Pemazyre(pemigatinib),该药是一种选择性成纤维细胞生长因子受体(FGFR)激酶抑制剂,适应症为:用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌(cholangiocarcinoma)患者。Pemazyre是根据总缓解率(ORR)和缓解持续时间(DOR)数据在加速审批程序和优先审批程序下获得批准,针对该适应症的持续批准,将取决于验证性试验中对临床益处的验证和描述。目前,Pemazyre也正在接受欧洲药品管理局(EMA)的审查。
值得一提的是,Pemazyre是第一个也是唯一一个获FDA批准用于治疗胆管癌的靶向药物,该药可通过阻断肿瘤细胞中的FGFR2来阻止肿瘤细胞的生长和扩散。由于胆管癌是一种医疗需求严重未满足的毁灭性癌症,Pemazyre之前已被授予了孤儿药资格、突破性药物资格、优先审查资格。
此次批准,基于FIGHT-202研究的数据。该研究在先前已接受过治疗的局部晚期或转移性胆管癌患者中开展,评估了Pemazyre的疗效和安全性。该研究的结果最近在欧洲肿瘤内科学会(ESMO)2019年大会上公布,数据显示:在携带FGFR2融合或重排的患者(队列A)中,中位随访15个月,Pemazyre单药治疗的总缓解率(ORR)为36%(主要终点),中位缓解持续时间(DoR)为9.1个月(次要终点)。
成纤维细胞生长因子受体(FGFR)在肿瘤细胞增殖、存活、迁移和血管生成(新生血管的形成)中起着重要作用。FGFR中的融合、重排、易位和基因扩增与多种肿瘤的发生发展密切相关。FGFR2融合或重排几乎只发生在肝内胆管癌(iCCA)中,在10-16%的患者中观察到。
Pemazyre的活性药物成分pemigatinib是一种针对FGFR异构体1、2、3的强效、选择性、口服小分子抑制剂,被证实针对发生FGFR基因改变的癌细胞具有强效和选择性药理学活性。2018年12月,信达生物与Incyte公司达成战略合作和独家授权许可协议,推进3款药物(itacitinib,parsaclisib,pemigatinib)的单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化。
4月17日,FDA批准西雅图遗传学公司(Seattle Genetics)靶向抗癌药Tukysa(tucatinib),联合曲妥珠单抗(trastuzumab)和卡培他滨(capecitabine),用于治疗不能手术切除并且先前已接受过一种或多种抗HER2方案的晚期或转移性HER2阳性乳腺癌成人患者,包括发生脑转移的患者。Tukysa是一种靶向HER2的口服小分子酪氨酸激酶抑制剂(TKI),HER2是一种有助于癌细胞生长的蛋白质。此次批准,较FDA先前指定的目标行动日期提前了4个月之多。目前,Tukysa也正在接受欧洲药品管理局(EMA)的审查。
在临床试验中,与曲妥珠单抗+卡培他滨方案相比,Tukysa+曲妥珠单抗+卡培他滨方案显著延长了无进展生存期(PFS:7.8个月 vs 5.6个月)、总生存期(OS:21.9个月 vs 17.4个月)、客观缓解率提高近一倍(40.6% vs 22.8%),并且在脑转移患者中也显示出同样的疗效。对于在转移性疾病中已接受一种或多种抗HER2方案的HER2阳性乳腺癌患者,Tukysa三药方案将成为一种标准护理方案。
之前,FDA已授予Tukysa三药方案突破性药物资格(BTD)和优先审查,并根据实时肿瘤学审查(RTOR)试点项目审查了Tukysa的新药申请(NDA)。此外,Tukysa NDA也是FDA Orbis试点项目的一部分,该项目是FDA肿瘤卓越中心于2019年9月推出的一项倡议,为FDA及其国际合作的监管机构提供了一个针对肿瘤学药物的共同提交和审查的协作框架。
HER2是一种生长因子受体,在多种癌症中过度表达,包括乳腺癌、结直肠癌和胃癌。HER2介导细胞生长、分化和存活。Tukysa的活性药物成分为tucatinib,这是一种口服生物有效的酪氨酸激酶抑制剂(TKI),对HER2具有高度选择性,对EGFR无明显抑制作用。EGFR的抑制与显著的毒性有关,包括皮疹和腹泻。tucatinib作为单一药物、联合化疗和其他HER2靶向药物(如曲妥珠单抗)已显示出治疗活性。对tucatinib联合用药开展的临床研究显示了系统性和针对脑转移的活性。
4月10日,FDA批准阿斯利康(AstraZeneca)靶向抗癌药Koselugo(selumetinib),用于年龄≥2岁的1型神经纤维瘤病(NF1)儿科患者,该药具体适应症为:用于治疗NF1相关的症状性、不能手术的丛状神经纤维瘤(PN)。值得一提的是,Koselugo是FDA批准的第一种治疗NF1的药物。在美国和欧盟,Koselugo被授予了治疗NF1的孤儿药资格。在美国,Koselugo还被授予了治疗NF1的突破性药物资格(BTD)。
NF1是一种致衰性、进行性、常常导致毁容的罕见疾病,这种疾病通常始于生命早期,由特定基因的突变或缺陷引起,导致肿瘤在神经上生长,这些肿瘤可以生长在身体的任何地方,包括面部、四肢、脊柱周围、身体深处可能影响器官的区域。NF1通常在儿童早期确诊,大约3000个婴儿中就有一个出现NF1,其特征是肤色(色素沉着)变化、神经和骨骼损伤、一生中发生良性和恶性肿瘤的风险。30%到50%的NF1患者出现一处或多处PN。
Koselugo的活性药物成分为selumetinib,这是一种口服、强效、选择性MEK1/2激酶抑制剂。NF1基因编码神经纤维瘤蛋白(neurofibromin),该蛋白对RAS/MAPK通路进行负调控,帮助控制细胞生长、分化和存活。NF1基因突变可能导致RAS/RAF/MEK/ERK信号途径失调,而这可能导致细胞以不受控制的方式生长、分裂和复制,并可能导致肿瘤生长。selumetinib通过抑制这条途径中的MEK酶,潜在地抑制肿瘤生长。
此次批准,基于SPRINT II期Stratum 1试验的阳性结果。该试验入组的儿科患者患有NF1和不能手术的PN(定义为不能完全切除但不会对患者造成严重发病风险的PN)。疗效结果来自50例接受推荐剂量的患者,试验期间对这些患者肿瘤大小的变化和肿瘤相关疾病进行了常规评估。试验期间,患者每天2次口服25 mg/m2的Koselugo,直到病情恶化或出现不可接受的不良反应。该临床试验测定了总缓解率(ORR),定义为:3-6个月通过MRI证实有完全缓解或部分缓解(PN肿瘤体积减少≥20%)的患者比例。
数据显示,Koselugo作为每日二次口服单药治疗的总缓解率(ORR)为66%(n=33/50),所有患者均为部分缓解(PR)。在这些患者中,82%的患者经历了持续12个月或更长时间的缓解。Koselugo治疗期间患者的其他临床结果,包括PN相关缺陷、症状和功能损害的变化。尽管评估每个PN相关发病率(如缺陷、疼痛、力量和活动性问题、气道压迫、视力损害和膀胱或肠功能障碍)的患者样本量很小,但治疗期间PN相关症状或功能缺陷似乎有改善的趋势。(生物谷Bioon.com)
原文出处:FDA新药数据库、生物谷
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->