胰腺癌研究进展一览
来源:本站原创 2020-03-28 04:42
本期为大家带来的是胰腺癌领域的研究进展,希望读者朋友们能够喜欢。
2020年3月20日讯/生物谷BIOON/---本期为大家带来的是胰腺癌领域的研究进展,希望读者朋友们能够喜欢。

这项临床1a期研究的目的是确定LY2510924的最大耐受剂量。LY2510924是一种CXCR4肽拮抗剂,在临床前研究中与PD-1抑制剂durvalumab联合使用具有明显的抗肿瘤活性。参与研究的患者患有晚期胰腺癌或直肠癌,并且对其他治疗无反应。在每个28天周期的第1天,患者接受20、30或40 mg LY2510924以及1500 mg durvalumab的治疗。结果显示,患者没有发生不良事件导致的死亡或需要中断三种剂量中的任何一种的现象。因此得出的结论是,每天最高剂量的LY2510924(40毫克)是安全且耐受性良好的,应在下一阶段的研究中加以使用。研究人员还报告说,在该试验中,有44%的患者对稳定疾病有最佳反应。
—约翰霍普金斯大学基梅尔癌症中心的研究人员说,在小鼠实验中,他们通过引入具有特定基因缺失的骨髓细胞来诱导一种新的免疫反应,从而减缓了移植的人类前列腺和胰腺癌细胞的生长。
这项研究结果于近日发表在《Journal for ImmunoTherapy of Cancer》上。研究结果表明,这项技术--一种过继细胞疗法--可以利用患者自身的骨髓细胞来治疗人类的这类癌症。
2020年3月14日讯 /生物谷BIOON /——约翰霍普金斯大学基梅尔癌症中心的研究人员说,在小鼠实验中,他们通过引入具有特定基因缺失的骨髓细胞来诱导一种新的免疫反应,从而减缓了移植的人类前列腺和胰腺癌细胞的生长。
这项研究结果于近日发表在《Journal for ImmunoTherapy of Cancer》上。研究结果表明,这项技术--一种过继细胞疗法--可以利用患者自身的骨髓细胞来治疗人类的这类癌症。
"在这些小鼠研究的基础上,这种方法可能提供一种独特的方法来激活患者的免疫系统,包括T细胞,以对抗癌症,"儿科肿瘤学家、医学博士、约翰霍普金斯大学基梅尔癌症中心的King Fahd儿科肿瘤学教授Alan Friedman说道。
Friedman说,先前的研究已经表明,当他们缺乏这个基因称为NF-κB p50时,免疫反应的关键细胞--巨噬细胞和树突细胞更有可能帮助打赢一场炎症战。转录因子是一种蛋白质,它通过与附近的DNA结合来帮助特定的基因"开启"或"关闭"。
过去的研究还表明,在缺乏转录因子的小鼠中,黑色素瘤、纤维肉瘤、结肠癌和脑癌胶质母细胞瘤的生长速度较慢。Friedman说,这项新研究被认为是首次在缺乏p50的小鼠身上显示出同样的生长缓慢效应,这种效应适用于患有前列腺癌和胰腺癌的小鼠。
为了开发和测试他们的过继细胞治疗技术,研究人员首先从p50缺陷小鼠的骨髓中培养出未成熟的髓细胞,并将其与携带p50基因的小鼠进行比较。髓细胞是一种血液细胞,也被称为白细胞。之所以选择包括巨噬细胞和树突状细胞前体在内的未成熟髓细胞,是因为过去的研究已经证实,这些特殊的细胞增加了激活抗肿瘤免疫反应的可能性。
在给两组小鼠都接种了人类前列腺癌细胞或胰腺癌细胞后,研究人员用一种被广泛使用的抗癌药物5-氟尿嘧啶对小鼠进行预处理,然后注射未成熟的骨髓细胞。众所周知,这种药物会导致正常骨髓血细胞的数量减少,从而减少与注射细胞的竞争;可以靶向肿瘤中抑制免疫反应的髓细胞;有时还可以释放T细胞识别的抗原,触发这些免疫细胞攻击肿瘤。
研究人员发现,将p50阴性细胞"过继转移"与5-氟尿嘧啶联合使用效果最佳。与给予p50完整细胞的小鼠相比,在14例前列腺癌中的13例(93%)和15例胰腺癌中的8例(53%)中,肿瘤的生长速度至少慢了3倍。研究人员称,该疗法还使小鼠的胰腺癌发生了"显着的"消退,肿瘤体积缩小了10倍。
研究人员报告说,转移的p50阴性的髓细胞产生了巨噬细胞和树突状细胞,这些细胞通过激活T细胞来帮助免疫系统对抗癌症。当T细胞被耗尽以测试它们的激活是否与肿瘤生长的减少直接相关时,细胞过继治疗不再有效。在p50阴性的结肠癌小鼠和胶质母细胞瘤小鼠中也发现了类似的效应,在结肠癌小鼠中,T细胞的耗竭增加了它们的癌症发展,而在胶质母细胞瘤小鼠中,当T细胞耗竭时,它们相对于野生型小鼠的生存优势消失了。Friedman说。"我们测试了七种不同癌症--胰腺癌、脑癌、黑色素瘤、结肠癌、肉瘤和成神经细胞瘤,都证明回输缺乏NF-κB p50的细胞可以显着抑制肿瘤生长。"(生物谷Bioon.com)
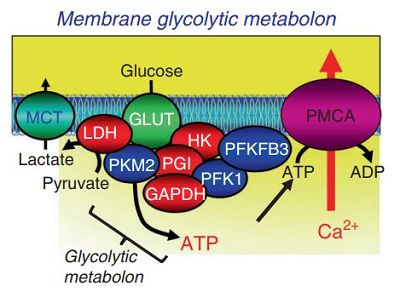
细胞内的钙通常是有益的,因为它控制许多细胞功能。然而,钙水平受到严格控制,通常维持在非常低的水平,因为钙的长期升高会导致细胞死亡。这种严密的控制是通过细胞表面的钙泵实现的,它利用化学能将钙泵出细胞。研究人员发现,切断癌细胞的能量供应会导致水泵失灵,钙离子上升,就像一艘受损的船进水一样。
曼彻斯特大学癌症科学部的Jason Bruce博士领导了这项研究,他说:"胰腺癌的存活率统计数据是最糟糕的,而且对标准治疗方法是出了名的耐受。因此,如果我们要对付这种毁灭性的疾病,识别胰腺癌细胞的潜在弱点并选择性地杀死它们--本质上就是找到它们的'致命弱点'-- 仍然必须是一项中心研究战略。"
这项由英国慈善机构胰腺癌研究基金会资助的研究发现,胰腺癌细胞有一种独特的方式从糖中提取能量,为它们的钙泵提供能量。他们使用一种特殊的酶,称为PKM2,研究人员发现,与周围的胰腺癌患者的健康组织相比,PKM2在肿瘤中含量很高。他们还发现,肿瘤中PKM2的数量与患者生存期较差有关,这表明PKM2可以作为治疗胰腺癌的靶点。
曼彻斯特团队随后在实验室对胰腺癌细胞进行了实验,以找出如果他们使用两种不同的方法关闭PKM2会发生什么。第一种方法针对的是制造PKM2蛋白的机制,这最终导致了癌细胞内PKM2的急剧减少或"敲除"。第二种方法使用一种自然产生的PKM2阻滞剂,称为紫草素,它阻止PKM2发挥作用。紫草素最初是从紫草的干根中提取出来的,在中药中也有使用。
紫草素在短短几小时内就能有效杀死胰腺癌细胞。处理过的细胞已经耗尽了能量,这反过来导致了它们的钙泵的故障和钙的毒性上升。紫草素还阻止了细胞的生长和迁移,这意味着对癌症扩散的影响。
该团队现在打算寻找针对PKM2和其他针对类似产能酶的药物的特异性更强的药物,并研究这种方法是否可以发展成一种新的胰腺癌治疗方法。
"虽然紫草素在实验室中被证明是非常有效的,但它可能会对身体产生额外的副作用,使其在病人身上的作用降低。因此,我们的目标是设计新的药物,选择性地针对这一过程,选择性地杀死胰腺癌细胞,同时让依赖替代能源的健康细胞相对完整。
-胰腺癌是人类最具侵袭性和致命性的恶性肿瘤之一,预后极差,因此迫切需要更有效的治疗手段来治疗胰腺癌。
为了开发针对胰腺癌的有效新药物,近日来自美国亚利桑那大学的Wang Wei课题组提出了一种新的、有效的治疗策略,即使用小分子抑制剂同时针对溴域和额外末端结构域蛋白(BET蛋白)和组蛋白去乙酰化酶(HDAC),研究人员合理地设计了一系列小分子药物,并筛选出了最有希望的胰腺癌治疗药物。
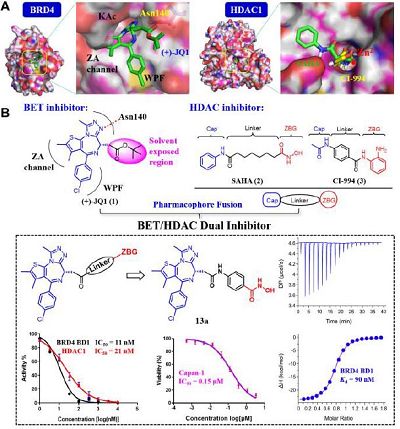
值得注意的是,该化合物的体内外抗肿瘤活性高于BET抑制剂(+)‐JQ1、HDAC抑制剂vorinostat以及它们的组合,这表明这种新型的BET/HDAC双抑制剂在胰腺癌治疗中的具有优势,因此有望在未来帮助治疗胰腺癌。
这项研究中,研究人员进行了迄今为止最全面的胰腺癌分子亚型分析,通过详细的基因组和转录组学分析,研究人员识别出了五种不同的亚型,即基底样A亚型、基底样B亚型、典型A亚型、典型B亚型和混合型,每一种亚型都有特殊的分子特性,其或能被新型化疗、生物学和免疫疗法所靶向作用。

研究者Faiyaz Notta博士指出,由于我们对这种致死性疾病的分子亚型并不完全了解,因此对于胰腺癌的疗法的开发一直受到了阻碍;通过对恶性胰腺癌进行深入分析,研究人员或有望开发出新型疾病进展预测模型,同时也能帮助开发新型个体化胰腺癌疗法。文章中,研究人员对加入到COMPASS临床试验的300多名早期和恶性胰腺癌患者进行研究分析,该临床试验旨在开发新型胰腺癌个体化疗法。
研究人员表示,大部分胰腺癌研究都重点关注早期或可切除的肿瘤,但实际上,当胰腺癌开始进展并扩散到机体其它器官时,患者才会被诊断患有该病;COMPASS试验能帮助研究人员在治疗患者的同时深入分析这种恶性癌症,同时阐明转移性胰腺癌背后的生物学机制以及驱动疾病进展的原因。有意思的是,在这项研究之前,研究人员发现,很难观察到的基底样A亚型胰腺癌或与特殊遗传异常相关;大部分的基底样A亚型肿瘤都包含突变KRAS基因的多个拷贝,即突变KRAS的遗传扩增,研究人员假设,部分亚型或许源于特殊的遗传改变,而随着胰腺癌进展这类特殊的遗传改变会不断发生。
最后研究者Steven Gallinger指出,本文研究或为开发新型胰腺癌疗法提供了新的线索和思路;如今我们非常期待利用当前的研究结果来理解多种胰腺癌亚型发生的分子机制,从而为后期开发新型个体化疗法奠定基础。
日前,一项刊登在国际杂志ChemMedChem上的研究报告中,来自英国巴斯大学等机构的科学家们通过研究受一种热带花卉中的特殊化合物的启发开发出了一种药物样的分子,其或有望帮助治疗致死性的胰腺癌。胰腺癌是一种致死率极高的癌症,英国大约每年有1万名患者会死于胰腺癌,患者的平均存活期不超过6个月,同时胰腺癌在英国还是第三大癌症相关死亡的主要原因。
文章中,研究人员在热带植物大花紫玉盘(Uvaria grandiflora)中发现了一种名为Grandifloracin的特殊化合物,基于此他们开发出了与该分子非常相似的新型分子,研究结果表明,这三种分子均能杀灭培养皿的胰腺癌细胞,其中两种分子比Grandifloracin分子的作用效果更有效。
由于胰腺癌往往并不会引起很明显的症状,因此当癌症扩散到其它器官中时患者才会意识到患病,胰腺癌是一种非常难以治疗的癌症,因为胰腺肿瘤会对多种抗癌药物产生耐受性,因此研究人员所开发的分子或有望作为一种有效抵御胰腺癌的有用工具。研究者Simon Lewis说道,胰腺癌侵袭性较强,且进展迅速,因此肿瘤的生长速度常常会超过血管为其提供的营养,这就会造成胰腺肿瘤缺少养分,这就会导致胰腺癌通常会杀灭普通的细胞,并且进化出能够在严峻条件下存活并继续生长的能力。
研究者所鉴别的分子名为“抗朴素因子”(anti-austerity agents),其能破坏癌细胞耐受多种饥饿状况的能力,最终引发癌细胞死亡,这样具有正常营养供应的普通细胞则不会受到影响。经过不断进化,大自然中的植物会产生大量的活性化合物,这些天然化合物对于开发治疗多种人类疾病的新药具有非常重要的意义,目前大约四分之一的药物都来源于植物。
在一项新的研究中,来自美国纽约大学医学院的研究人员揭示了一种通过劫持从周围环境吸收营养物的过程来帮助胰腺癌细胞避免挨饿的机制。他们解释了RAS基因发生的突变不仅促进在90%的胰腺癌患者中观察到的异常生长,而且还加快为这种生长提供所需的氨基酸和代谢物的过程。相关研究结果近期发表在Nature期刊上,论文标题为“Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis”。
这种过程称为巨胞饮作用(macropinocytosis),即一种吞噬蛋白和脂肪的过程,所吞噬的蛋白和脂肪经分解后产生氨基酸和代谢物,可用于构建新的蛋白、DNA链和细胞膜。如果缺乏这些氨基酸和代谢物,癌细胞就无法增殖。
论文第一作者、纽约大学医学院生物化学与分子生物学系博士后研究员Craig Ramirez博士说,“我们发现一种与营养物供应有关的机制,我们认为这种机制赋予RAS突变肿瘤细胞一种关键的生存机制。”
具体来说,这些研究人员发现RAS突变进一步激活了SLC4A7蛋白,这使得一种称为碳酸氢盐依赖性可溶性腺苷酸环化酶的蛋白能够激活蛋白激酶A。这接着又改变了酶v-ATPase的位置。

这些研究人员说,通过将v-ATPase的作用范围从细胞的深处转移到它们的外膜附近,这种转移使得这种酶的定位合适递送将RAC1附着到细胞膜上所需的胆固醇。v-ATPase在外膜附近的积累以及Rac1的相关定位使得细胞膜在巨胞饮过程中暂时凸起、翻滚并形成吞噬营养物的囊泡。
在细胞培养物研究中,用SLC4蛋白家族抑制剂S0859处理RAS突变肿瘤细胞可导致RAS依赖性的v- ATPase外膜定位显著减少,并抑制了微胞饮作用(micropinocytosis)。
此外,对来自人胰导管腺癌(PDAC)组织的分子数据的分析表明编码SLC4A7的基因在肿瘤中的表达比正常的附近胰腺组织高四倍。
这些研究人员还发现沉默胰腺癌细胞中的SLC4A7基因可以减缓或缩小小鼠体内的肿瘤。
论文通讯作者、纽约大学医学院的Dafna Bar-Sagi博士说,“我们如今正在寻找可能抑制SLC4A7或v-ATPase的候选药物,它们可作为阻止巨胞饮作用的未来潜在治疗方法。这两种蛋白在原则上都是良好的靶标,这是因为它们与癌症的生长有关,并在癌细胞表面附近发挥作用,通过血液输送的药物可以到达它们那里。”
胰腺癌对当前所有疗法都已经产生了耐药性,患者被诊断后5年的存活率极低;近日,一项刊登在国际杂志Oncotarget上的研究报告中,来自以色列特拉维夫大学等机构的科学家们通过研究发现了一种特殊的小型分子,其或能诱导胰腺癌细胞自我毁灭,这项研究中,研究人员利用异种移植物进行研究,即将人类胰腺癌组织移植到免疫功能受损的小鼠机体中,研究者表示,这种疗法能减少小鼠机体中高达90%的癌细胞。
研究者认为,相关研究结果有望帮助开发治疗包括胰腺癌在内的多种癌症的新型有效疗法。研究者Cohen-Armon表示,在2017年发表的一篇研究报告中,我们揭示了一种新型机制,其能在有丝分裂期间诱发人类癌细胞自毁,同时还不会影响机体正常的细胞;如今研究人员希望能通过利用相关的信息来有效消除异种移植物机体中的人类胰腺癌细胞,他们能利用这种特殊的小分子在多种人类癌细胞中实现细胞自毁的目的。
这种分子名为PJ34,其能穿透细胞膜但仅会影响癌细胞;同时该分子还会在人类癌细胞复制过程中引起异常表现,从而促进细胞快速死亡,而细胞增殖本身也会导致所治疗的癌细胞发生死亡。注射PJ34一个月后再持续注射14天,研究者发现,小鼠机体肿瘤中的胰腺癌细胞会下降90%的比例,在其中一只小鼠中,肿瘤完全消失了。
最后研究者Cohen-Armon表示,值得注意的是,我们并未观察到不良反应,另外,小鼠机体的体重和行为也并未发生变化;这种机制或许在对当前疗法产生耐受性的其它癌症中也会有效发挥作用,目前FDA已经批准PJ34分子能进行临床前试验。
近日,一项刊登在国际杂志Nature Cell Biology上的研究报告中,来自Sanford Burnham Prebys医学发现研究所的科学家们通过研究鉴别出了一种由两种抗癌化合物组成的药物组合,其或能有效促进小鼠机体中的胰腺肿瘤萎缩,这或许有望支持这种药物在临床实验中进行直接评估,此前FDA批准这种化合物组合用以治疗某些白血病和实体瘤,包括黑色素瘤等。
研究者Ze'ev Ronai博士表示,如今胰腺癌的治疗非常滞后,因为缺乏有效的疗法来攻击这种肿瘤组织;这项研究中,我们鉴别出了一种潜在的疗法组合,其或能用来帮助抵御恶性的胰腺癌;目前研究人员正在与俄勒冈健康与科学大学的肿瘤学家们讨论如何将这种新方法用于临床评估之中。

胰腺癌是一种致死性的癌症,其通常难以诊断,因为直到患者疾病进入到晚期才会出现疾病症状,比如腹部疼痛、皮肤和眼睛发黄、体重减轻等。仅有不到10%的胰腺癌患者能存活超过5年时间,据美国癌症协会数据显示,2019年将会有超过5.6万美国人接受胰腺癌的诊断。
这项研究中,研究人员利用一种名为L-门冬酰胺酶(L-Asparaginase)的药物让胰腺肿瘤缺乏关键的营养物质(天冬酰胺)而饿死,天冬酰胺是一种蛋白质合成所需的氨基酸;研究者发现,胰腺癌并不会死亡,其会开启一种压力反应通路,来促进癌细胞自身产生天冬酰胺,随后他们利用第二种药物来治疗胰腺癌小鼠,这种药物能阻断癌细胞的压力反应通路并促使胰腺肿瘤发生萎缩。目前FDA批准L-门冬酰胺酶用来治疗特定的白血病,而第二种药物名为MEK抑制剂,其被批准用来治疗诸如黑色素瘤等皮肤癌。
医学博士Eytan Ruppin指出,本文研究为阐明天冬酰胺抑制剂和MAPK信号抑制剂联合作用来攻击胰腺肿瘤、抑制其生长奠定了基础;后期我们将会通过对患者的数据进行深入的计算分析来进一步支持相关的研究发现。很显然,研究人员目前并不能找到治疗癌症(尤其是胰腺癌)的单一灵丹妙药,而是需要找到针对癌症多个弱点的几种药物,本文研究发现为治疗胰腺癌提供了一种新型策略;研究者希望后期能够很快在胰腺癌患者机体中进行药物疗效的测试。
近日,来自克里克大学的研究人员发现了一种蛋白质可促进胰腺癌的生长,这一蛋白可能成为新的胰腺癌治疗的靶标。
相关研究结果发表在最近的《Nature Cell Biology》杂志上。
胰管腺癌是胰腺癌最常见的一种类型,它是一种从胰腺和肾小管细胞发展而来的侵袭性癌症。目前没有有效的疗法可以治疗这种癌症,诊断后仅有8%的患者能够存活超过五年。
这项研究进一步证实了这种蛋白质不仅是癌症干细胞的标志物,而且还促进了它们的恶化行为。通过改变小鼠肿瘤细胞中CD9的含量,研究者们发现:当这种蛋白水平降低时,肿瘤的体积相应会变小。相反,CD9水平的提高会使得癌细胞更具侵略性,并能迅速形成大的肿瘤。
这些发现与现有临床数据不谋而合,后者显示肿瘤细胞中CD9含量较高的患者的预后效果较差。“这些细胞对胰腺癌的发展至关重要,因此,我们需要找到有效的方法去除这些细胞,从而阻止它们对癌症的发展的促进作用。但是,我们需要更多的实验来验证CD9在人类胰腺癌中的重要性。” Crick成人干细胞实验室的主要作者和成员Victoria Wang说。
为了了解CD9促进癌症恶化的机制,研究小组研究了癌症干细胞的代谢情况。他们的发现表明,CD9可增加细胞摄取谷氨酰胺的速率,而谷氨酰胺是一种氨基酸,有助于为癌症的生长提供能量。
“现在我们知道这种蛋白质既与癌症干细胞相关,又有助于癌症的生长,这一发现有助于针对该蛋白质的新疗法的开发,从而切断向癌症干细胞供应的谷氨酰胺的供应,达到使癌细胞‘饿死’的目的”。该文章的通讯作者Axel Behrens说。(生物谷 Bioon.com)

1.J Pancreatic Cancer: 药物组合治疗胰腺癌显示出安全性
一项新研究显示,与PD-1抑制剂联合使用的新型肽拮抗剂在治疗晚期,难治性胰腺癌和直肠癌患者中显示出较好的安全性与耐受性。相关结果发表在《Journal of Pancreatic Cancer》杂志上。
这篇名为“ CXCR4肽拮抗剂LY2510924与Durvalumab联合用于晚期难治性实体瘤的安全性和药代动力学”的研究由宾夕法尼亚大学艾布拉姆森癌症中心医学博士Mark O'Hara与科罗拉多大学医学院的同事合作完成,芝加哥大学,礼来公司,阿斯特拉·塞内卡大学和圣路易斯华盛顿大学医学院也参与了研究。

2.J ImmunoTher Cancer:工程化骨髓细胞延缓胰腺癌生长
这项研究结果于近日发表在《Journal for ImmunoTherapy of Cancer》上。研究结果表明,这项技术--一种过继细胞疗法--可以利用患者自身的骨髓细胞来治疗人类的这类癌症。
2020年3月14日讯 /生物谷BIOON /——约翰霍普金斯大学基梅尔癌症中心的研究人员说,在小鼠实验中,他们通过引入具有特定基因缺失的骨髓细胞来诱导一种新的免疫反应,从而减缓了移植的人类前列腺和胰腺癌细胞的生长。

"在这些小鼠研究的基础上,这种方法可能提供一种独特的方法来激活患者的免疫系统,包括T细胞,以对抗癌症,"儿科肿瘤学家、医学博士、约翰霍普金斯大学基梅尔癌症中心的King Fahd儿科肿瘤学教授Alan Friedman说道。
Friedman说,先前的研究已经表明,当他们缺乏这个基因称为NF-κB p50时,免疫反应的关键细胞--巨噬细胞和树突细胞更有可能帮助打赢一场炎症战。转录因子是一种蛋白质,它通过与附近的DNA结合来帮助特定的基因"开启"或"关闭"。
过去的研究还表明,在缺乏转录因子的小鼠中,黑色素瘤、纤维肉瘤、结肠癌和脑癌胶质母细胞瘤的生长速度较慢。Friedman说,这项新研究被认为是首次在缺乏p50的小鼠身上显示出同样的生长缓慢效应,这种效应适用于患有前列腺癌和胰腺癌的小鼠。
为了开发和测试他们的过继细胞治疗技术,研究人员首先从p50缺陷小鼠的骨髓中培养出未成熟的髓细胞,并将其与携带p50基因的小鼠进行比较。髓细胞是一种血液细胞,也被称为白细胞。之所以选择包括巨噬细胞和树突状细胞前体在内的未成熟髓细胞,是因为过去的研究已经证实,这些特殊的细胞增加了激活抗肿瘤免疫反应的可能性。
在给两组小鼠都接种了人类前列腺癌细胞或胰腺癌细胞后,研究人员用一种被广泛使用的抗癌药物5-氟尿嘧啶对小鼠进行预处理,然后注射未成熟的骨髓细胞。众所周知,这种药物会导致正常骨髓血细胞的数量减少,从而减少与注射细胞的竞争;可以靶向肿瘤中抑制免疫反应的髓细胞;有时还可以释放T细胞识别的抗原,触发这些免疫细胞攻击肿瘤。
研究人员发现,将p50阴性细胞"过继转移"与5-氟尿嘧啶联合使用效果最佳。与给予p50完整细胞的小鼠相比,在14例前列腺癌中的13例(93%)和15例胰腺癌中的8例(53%)中,肿瘤的生长速度至少慢了3倍。研究人员称,该疗法还使小鼠的胰腺癌发生了"显着的"消退,肿瘤体积缩小了10倍。
研究人员报告说,转移的p50阴性的髓细胞产生了巨噬细胞和树突状细胞,这些细胞通过激活T细胞来帮助免疫系统对抗癌症。当T细胞被耗尽以测试它们的激活是否与肿瘤生长的减少直接相关时,细胞过继治疗不再有效。在p50阴性的结肠癌小鼠和胶质母细胞瘤小鼠中也发现了类似的效应,在结肠癌小鼠中,T细胞的耗竭增加了它们的癌症发展,而在胶质母细胞瘤小鼠中,当T细胞耗竭时,它们相对于野生型小鼠的生存优势消失了。Friedman说。"我们测试了七种不同癌症--胰腺癌、脑癌、黑色素瘤、结肠癌、肉瘤和成神经细胞瘤,都证明回输缺乏NF-κB p50的细胞可以显着抑制肿瘤生长。"(生物谷Bioon.com)
3.Brit J Cancer:研究揭示胰腺癌潜在的新治疗策略
英国科学家发现了一种杀死胰腺癌细胞的新方法,即"拔掉"细胞表面的能量发生器的电源插头。这项研究发表在《British Journal of Cancer》上,报告了切断癌症的能量供应是如何导致一种不可逆转的钙沉积,从而导致胰腺癌细胞"中毒"的。

细胞内的钙通常是有益的,因为它控制许多细胞功能。然而,钙水平受到严格控制,通常维持在非常低的水平,因为钙的长期升高会导致细胞死亡。这种严密的控制是通过细胞表面的钙泵实现的,它利用化学能将钙泵出细胞。研究人员发现,切断癌细胞的能量供应会导致水泵失灵,钙离子上升,就像一艘受损的船进水一样。
曼彻斯特大学癌症科学部的Jason Bruce博士领导了这项研究,他说:"胰腺癌的存活率统计数据是最糟糕的,而且对标准治疗方法是出了名的耐受。因此,如果我们要对付这种毁灭性的疾病,识别胰腺癌细胞的潜在弱点并选择性地杀死它们--本质上就是找到它们的'致命弱点'-- 仍然必须是一项中心研究战略。"
这项由英国慈善机构胰腺癌研究基金会资助的研究发现,胰腺癌细胞有一种独特的方式从糖中提取能量,为它们的钙泵提供能量。他们使用一种特殊的酶,称为PKM2,研究人员发现,与周围的胰腺癌患者的健康组织相比,PKM2在肿瘤中含量很高。他们还发现,肿瘤中PKM2的数量与患者生存期较差有关,这表明PKM2可以作为治疗胰腺癌的靶点。
曼彻斯特团队随后在实验室对胰腺癌细胞进行了实验,以找出如果他们使用两种不同的方法关闭PKM2会发生什么。第一种方法针对的是制造PKM2蛋白的机制,这最终导致了癌细胞内PKM2的急剧减少或"敲除"。第二种方法使用一种自然产生的PKM2阻滞剂,称为紫草素,它阻止PKM2发挥作用。紫草素最初是从紫草的干根中提取出来的,在中药中也有使用。
紫草素在短短几小时内就能有效杀死胰腺癌细胞。处理过的细胞已经耗尽了能量,这反过来导致了它们的钙泵的故障和钙的毒性上升。紫草素还阻止了细胞的生长和迁移,这意味着对癌症扩散的影响。
该团队现在打算寻找针对PKM2和其他针对类似产能酶的药物的特异性更强的药物,并研究这种方法是否可以发展成一种新的胰腺癌治疗方法。
"虽然紫草素在实验室中被证明是非常有效的,但它可能会对身体产生额外的副作用,使其在病人身上的作用降低。因此,我们的目标是设计新的药物,选择性地针对这一过程,选择性地杀死胰腺癌细胞,同时让依赖替代能源的健康细胞相对完整。
4.Angew Chem:华人学者开发强效胰腺癌新药
-胰腺癌是人类最具侵袭性和致命性的恶性肿瘤之一,预后极差,因此迫切需要更有效的治疗手段来治疗胰腺癌。
为了开发针对胰腺癌的有效新药物,近日来自美国亚利桑那大学的Wang Wei课题组提出了一种新的、有效的治疗策略,即使用小分子抑制剂同时针对溴域和额外末端结构域蛋白(BET蛋白)和组蛋白去乙酰化酶(HDAC),研究人员合理地设计了一系列小分子药物,并筛选出了最有希望的胰腺癌治疗药物。
研究人员发现,一种强效双抑制剂(13a)对BRD4 BD1 (IC 50 = 11 nM)和HDAC1 (IC 50 = 21 nM)具有良好的平衡活性。

值得注意的是,该化合物的体内外抗肿瘤活性高于BET抑制剂(+)‐JQ1、HDAC抑制剂vorinostat以及它们的组合,这表明这种新型的BET/HDAC双抑制剂在胰腺癌治疗中的具有优势,因此有望在未来帮助治疗胰腺癌。
5.Nat Genet:科学家鉴别出恶性胰腺癌新亚型
近日,一项刊登在国际杂志Nature Genetics上的研究报告中,来自加拿大安大略省癌症研究所等机构的科学家们通过研究鉴别出了新型的胰腺癌亚型,深入理解这类胰腺癌的发病机制或有望帮助开发新型治疗手段并改善这种致死性疾病患者的临床预后状况。这项研究中,研究人员进行了迄今为止最全面的胰腺癌分子亚型分析,通过详细的基因组和转录组学分析,研究人员识别出了五种不同的亚型,即基底样A亚型、基底样B亚型、典型A亚型、典型B亚型和混合型,每一种亚型都有特殊的分子特性,其或能被新型化疗、生物学和免疫疗法所靶向作用。

研究人员表示,大部分胰腺癌研究都重点关注早期或可切除的肿瘤,但实际上,当胰腺癌开始进展并扩散到机体其它器官时,患者才会被诊断患有该病;COMPASS试验能帮助研究人员在治疗患者的同时深入分析这种恶性癌症,同时阐明转移性胰腺癌背后的生物学机制以及驱动疾病进展的原因。有意思的是,在这项研究之前,研究人员发现,很难观察到的基底样A亚型胰腺癌或与特殊遗传异常相关;大部分的基底样A亚型肿瘤都包含突变KRAS基因的多个拷贝,即突变KRAS的遗传扩增,研究人员假设,部分亚型或许源于特殊的遗传改变,而随着胰腺癌进展这类特殊的遗传改变会不断发生。
最后研究者Steven Gallinger指出,本文研究或为开发新型胰腺癌疗法提供了新的线索和思路;如今我们非常期待利用当前的研究结果来理解多种胰腺癌亚型发生的分子机制,从而为后期开发新型个体化疗法奠定基础。
6.ChemMedChem:科学家有望利用热带花卉中的特殊化合物开发出治疗胰腺癌的新型药物

日前,一项刊登在国际杂志ChemMedChem上的研究报告中,来自英国巴斯大学等机构的科学家们通过研究受一种热带花卉中的特殊化合物的启发开发出了一种药物样的分子,其或有望帮助治疗致死性的胰腺癌。胰腺癌是一种致死率极高的癌症,英国大约每年有1万名患者会死于胰腺癌,患者的平均存活期不超过6个月,同时胰腺癌在英国还是第三大癌症相关死亡的主要原因。
文章中,研究人员在热带植物大花紫玉盘(Uvaria grandiflora)中发现了一种名为Grandifloracin的特殊化合物,基于此他们开发出了与该分子非常相似的新型分子,研究结果表明,这三种分子均能杀灭培养皿的胰腺癌细胞,其中两种分子比Grandifloracin分子的作用效果更有效。
由于胰腺癌往往并不会引起很明显的症状,因此当癌症扩散到其它器官中时患者才会意识到患病,胰腺癌是一种非常难以治疗的癌症,因为胰腺肿瘤会对多种抗癌药物产生耐受性,因此研究人员所开发的分子或有望作为一种有效抵御胰腺癌的有用工具。研究者Simon Lewis说道,胰腺癌侵袭性较强,且进展迅速,因此肿瘤的生长速度常常会超过血管为其提供的营养,这就会造成胰腺肿瘤缺少养分,这就会导致胰腺癌通常会杀灭普通的细胞,并且进化出能够在严峻条件下存活并继续生长的能力。
研究者所鉴别的分子名为“抗朴素因子”(anti-austerity agents),其能破坏癌细胞耐受多种饥饿状况的能力,最终引发癌细胞死亡,这样具有正常营养供应的普通细胞则不会受到影响。经过不断进化,大自然中的植物会产生大量的活性化合物,这些天然化合物对于开发治疗多种人类疾病的新药具有非常重要的意义,目前大约四分之一的药物都来源于植物。
如今,研究人员在热带植物大花紫玉盘中发现的特殊化合物就能有效且具有选择性地杀灭机体中的胰腺癌细胞;后期研究人员还将继续深入研究来以这种植物化合物为基础开发新型药物来更加有效且低毒地治疗胰腺癌患者。
7.Nature:RAS突变激活胰腺癌细胞的巨胞饮作用,使得它们避免挨饿
这种过程称为巨胞饮作用(macropinocytosis),即一种吞噬蛋白和脂肪的过程,所吞噬的蛋白和脂肪经分解后产生氨基酸和代谢物,可用于构建新的蛋白、DNA链和细胞膜。如果缺乏这些氨基酸和代谢物,癌细胞就无法增殖。
论文第一作者、纽约大学医学院生物化学与分子生物学系博士后研究员Craig Ramirez博士说,“我们发现一种与营养物供应有关的机制,我们认为这种机制赋予RAS突变肿瘤细胞一种关键的生存机制。”
具体来说,这些研究人员发现RAS突变进一步激活了SLC4A7蛋白,这使得一种称为碳酸氢盐依赖性可溶性腺苷酸环化酶的蛋白能够激活蛋白激酶A。这接着又改变了酶v-ATPase的位置。

在细胞培养物研究中,用SLC4蛋白家族抑制剂S0859处理RAS突变肿瘤细胞可导致RAS依赖性的v- ATPase外膜定位显著减少,并抑制了微胞饮作用(micropinocytosis)。
此外,对来自人胰导管腺癌(PDAC)组织的分子数据的分析表明编码SLC4A7的基因在肿瘤中的表达比正常的附近胰腺组织高四倍。
这些研究人员还发现沉默胰腺癌细胞中的SLC4A7基因可以减缓或缩小小鼠体内的肿瘤。
论文通讯作者、纽约大学医学院的Dafna Bar-Sagi博士说,“我们如今正在寻找可能抑制SLC4A7或v-ATPase的候选药物,它们可作为阻止巨胞饮作用的未来潜在治疗方法。这两种蛋白在原则上都是良好的靶标,这是因为它们与癌症的生长有关,并在癌细胞表面附近发挥作用,通过血液输送的药物可以到达它们那里。”
8.Oncotarget:新型疗法或能诱发胰腺癌细胞自我毁灭
研究者认为,相关研究结果有望帮助开发治疗包括胰腺癌在内的多种癌症的新型有效疗法。研究者Cohen-Armon表示,在2017年发表的一篇研究报告中,我们揭示了一种新型机制,其能在有丝分裂期间诱发人类癌细胞自毁,同时还不会影响机体正常的细胞;如今研究人员希望能通过利用相关的信息来有效消除异种移植物机体中的人类胰腺癌细胞,他们能利用这种特殊的小分子在多种人类癌细胞中实现细胞自毁的目的。

最后研究者Cohen-Armon表示,值得注意的是,我们并未观察到不良反应,另外,小鼠机体的体重和行为也并未发生变化;这种机制或许在对当前疗法产生耐受性的其它癌症中也会有效发挥作用,目前FDA已经批准PJ34分子能进行临床前试验。
9.Nat Cell Biol:一种新型的组合拳疗法有望治疗胰腺癌
研究者Ze'ev Ronai博士表示,如今胰腺癌的治疗非常滞后,因为缺乏有效的疗法来攻击这种肿瘤组织;这项研究中,我们鉴别出了一种潜在的疗法组合,其或能用来帮助抵御恶性的胰腺癌;目前研究人员正在与俄勒冈健康与科学大学的肿瘤学家们讨论如何将这种新方法用于临床评估之中。

这项研究中,研究人员利用一种名为L-门冬酰胺酶(L-Asparaginase)的药物让胰腺肿瘤缺乏关键的营养物质(天冬酰胺)而饿死,天冬酰胺是一种蛋白质合成所需的氨基酸;研究者发现,胰腺癌并不会死亡,其会开启一种压力反应通路,来促进癌细胞自身产生天冬酰胺,随后他们利用第二种药物来治疗胰腺癌小鼠,这种药物能阻断癌细胞的压力反应通路并促使胰腺肿瘤发生萎缩。目前FDA批准L-门冬酰胺酶用来治疗特定的白血病,而第二种药物名为MEK抑制剂,其被批准用来治疗诸如黑色素瘤等皮肤癌。
医学博士Eytan Ruppin指出,本文研究为阐明天冬酰胺抑制剂和MAPK信号抑制剂联合作用来攻击胰腺肿瘤、抑制其生长奠定了基础;后期我们将会通过对患者的数据进行深入的计算分析来进一步支持相关的研究发现。很显然,研究人员目前并不能找到治疗癌症(尤其是胰腺癌)的单一灵丹妙药,而是需要找到针对癌症多个弱点的几种药物,本文研究发现为治疗胰腺癌提供了一种新型策略;研究者希望后期能够很快在胰腺癌患者机体中进行药物疗效的测试。
此外,研究者还发现,两种治疗手段都能使得小鼠机体中的黑色素瘤缩小,由于目前胰腺癌的临床治疗需求巨大,因此后期科学家们还需要投入更大经历来开发治疗胰腺癌的有效疗法。
10.Nat Cell Biol:治疗胰腺癌的新靶点
相关研究结果发表在最近的《Nature Cell Biology》杂志上。
胰管腺癌是胰腺癌最常见的一种类型,它是一种从胰腺和肾小管细胞发展而来的侵袭性癌症。目前没有有效的疗法可以治疗这种癌症,诊断后仅有8%的患者能够存活超过五年。
在该研究中,研究人员分析了一组被称为“肿瘤干细胞“的亚群,这些细胞具有分化产生新肿瘤干细胞的能力,并且它们还可以分化为不同类型的肿瘤细胞亚群。
由于这些细胞是癌症生长的驱动力,因此能够识别它们是否存在是迈向开发新疗法的重要一步。通过分析这些癌症干细胞的基因表达,研究小组发现,无论是在肿瘤发展早期还是后期,肿瘤该细胞表明均表达一种名为CD9的蛋白质。因此,这种蛋白质可以用来作为标记,以帮助找到上述细胞亚群。

这项研究进一步证实了这种蛋白质不仅是癌症干细胞的标志物,而且还促进了它们的恶化行为。通过改变小鼠肿瘤细胞中CD9的含量,研究者们发现:当这种蛋白水平降低时,肿瘤的体积相应会变小。相反,CD9水平的提高会使得癌细胞更具侵略性,并能迅速形成大的肿瘤。
这些发现与现有临床数据不谋而合,后者显示肿瘤细胞中CD9含量较高的患者的预后效果较差。“这些细胞对胰腺癌的发展至关重要,因此,我们需要找到有效的方法去除这些细胞,从而阻止它们对癌症的发展的促进作用。但是,我们需要更多的实验来验证CD9在人类胰腺癌中的重要性。” Crick成人干细胞实验室的主要作者和成员Victoria Wang说。
为了了解CD9促进癌症恶化的机制,研究小组研究了癌症干细胞的代谢情况。他们的发现表明,CD9可增加细胞摄取谷氨酰胺的速率,而谷氨酰胺是一种氨基酸,有助于为癌症的生长提供能量。
“现在我们知道这种蛋白质既与癌症干细胞相关,又有助于癌症的生长,这一发现有助于针对该蛋白质的新疗法的开发,从而切断向癌症干细胞供应的谷氨酰胺的供应,达到使癌细胞‘饿死’的目的”。该文章的通讯作者Axel Behrens说。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


