HER2阳性乳腺癌重磅新药!第一三共抗体药物偶联物Enhertu在日本获批,总缓解率64.1%!
来源:本站原创 2020-03-26 10:13
2020年03月26日/生物谷BIOON/--第一三共制药(Daiichi Sankyo)近日宣布,日本厚生劳动省(MHLW)已批准Enhertu(trastuzumab deruxtecan,DS-8201),用于治疗HER2阳性、不可切除性或转移性、在先前化疗后复发的乳腺癌患者(限用于对标准治疗无效或不耐受的患者)。在美国,Enhertu于2019年12
2020年03月26日/生物谷BIOON/--第一三共制药(Daiichi Sankyo)近日宣布,日本厚生劳动省(MHLW)已批准Enhertu(trastuzumab deruxtecan,DS-8201),用于治疗HER2阳性、不可切除性或转移性、在先前化疗后复发的乳腺癌患者(限用于对标准治疗无效或不耐受的患者)。在美国,Enhertu于2019年12月获得加速批准,用于在转移性疾病中已接受过2种或2种以上抗HER2药物治疗的HER2阳性转移性乳腺癌成人患者。
此次批准,基于注册II期试验DESTINY-Breast01的结果。这是一项关键性、单臂、开放标签、全球性、多中心、两部分试验,正在评估Enhertu(5.4mg/kg)作为单药疗法治疗HER2阳性、不可切除性和/或转移性乳腺癌患者安全性和有效性。该研究共入组了全球100多个临床地点的184例患者(包括30例日本女性患者),这些患者既往已接受过2种或多种HER2靶向方案,治疗转移性疾病的既往疗法中位数为6(范围:2-27),既往疗法包括:trastuzumab-emtansine(T-DM1,100%的患者)、曲妥珠单抗(100%的患者)、pertuzumab(65.8%的患者)、其他抗HER2疗法(54.3%的患者)、激素疗法(48.9%的患者)和其他系统性治疗(99.5%的患者)。研究主要终点是客观缓解率(ORR)。
结果显示,在167例可评估患者中,有107例病情实现缓解,即Enhertu单药(5.4mg/kg)治疗的ORR为64.1%(95%CI:56.3-71.3)、中位缓解持续时间(DOR)为14.8个月。截至2019年3月21日数据截止日期,共有26例日本女性患者被纳入ORR分析。该研究中Enhertu的安全性和耐受性与I期试验中观察到的一致。
第一三共日本研发部门负责人、肿瘤功能负责人Wataru Takasaki表示:“我们很高兴为日本HER2阳性转移性乳腺癌患者带来我们的第一个ADC产品Enhertu,该药在先前已接受过多种疗法的HER2阳性转移性乳腺癌患者中显示出了令人印象深刻的结果,大多数患者从治疗中受益,治疗的中位缓解持续时间超过14个月。Enhertu也是过去一年内公司肿瘤学管线中第二个在日本获得批准的创新疗法,这是一个里程碑。”
乳腺癌病例中大约20%为HER2阳性,尽管近年来已取得治疗进展并有多款新药获批,但晚期HER2阳性转移性乳腺癌患者中仍存在着显著的临床需求。这种疾病仍然是无法治愈的,患者在接受目前可用的疗法后最终会病情进展。
HER2是一种酪氨酸激酶受体促生长蛋白,存在于某些癌细胞表面,与乳腺癌患者的侵袭性疾病和预后较差相关。肿瘤细胞通常采用免疫组织化学分析(IHC)或荧光原位杂交(FISH)两种方法之一进行检测HER2的表达。IHC检测结果报告为:ICH 0、IHC 1+、IHC 2+、IHC 3+。发现ICH 3+和/或FISH扩增被认为是HER2阳性。目前,还没有针对HER2 FISH阴性、IHC2+或IHC1+肿瘤的HER2靶向药物。

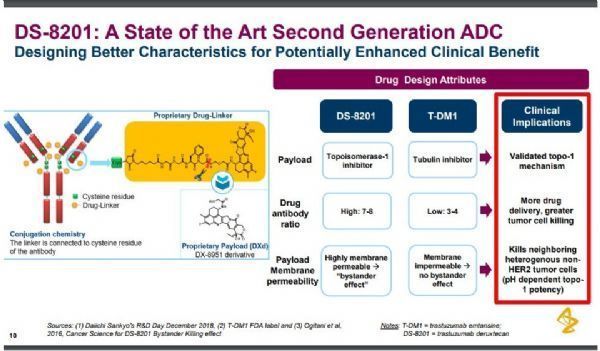
Enhertu(trastuzumab deruxtecan,DS-8201)是一种新一代ADC药物,通过一种4肽链接子将靶向HER2的人源化单克隆抗体trastuzumab(曲妥珠单抗)与一种新型拓扑异构酶1抑制剂exatecan衍生物(DX-8951衍生物,DXd)链接在一起,可靶向递送细胞毒制剂至癌细胞内,与通常的化疗相比,可减少细胞毒制剂的全身暴露。
2019年3月,阿斯利康与第一三共达成了一项总价值高达69亿美元的免疫肿瘤学合作,共同开发Enhertu,用于治疗各种HER2表达水平或HER2突变的癌症患者,包括胃癌、结直肠癌和肺癌,以及HER2低表达的乳腺癌。根据协议,双方将在全球范围内共同开发和商业化Enhertu,第一三共保留日本市场的独家权利,同时将全权负责制造和供应。
医药市场调研机构EvaluatePharma此前预测,上市后,Enhertu在2024年的销售额预计将达到20亿美元。(生物谷Bioon.com)
原文出处:ENHERTU® approved in Japan for Treatment of Patients with HER2 Positive Unresectable or Metastatic Breast Cancer
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


