Blueprint精准疗法2期数据积极 治疗罕见免疫疾病
来源:药明康德 2020-03-18 12:35
17日,Blueprint Medicines公司宣布,其开发的口服KIT和PDGFRα抑制剂avapritinib,在治疗惰性系统性肥大细胞增多症(systemic mastocytosis,SM)患者的2期临床试验PIONEER中,对患者的综合症状显示出具有临床意义的显着改善。SM是由于肥大细胞不可控制的增生和激活导致的罕见疾病。它有几种形式
17日,Blueprint Medicines公司宣布,其开发的口服KIT和PDGFRα抑制剂avapritinib,在治疗惰性系统性肥大细胞增多症(systemic mastocytosis,SM)患者的2期临床试验PIONEER中,对患者的综合症状显示出具有临床意义的显着改善。
SM是由于肥大细胞不可控制的增生和激活导致的罕见疾病。它有几种形式,包括惰性SM,侵袭性SM和晚期SM。肥大细胞是一种免疫细胞,它们产生组胺和其它介导炎症和过敏反应的因子。在SM患者中,这些因子高水平的释放会导致不同程度的症状,包括疼痛,恶心,皮疹,发热,疲劳等。严重时,SM患者的多个器官系统都会出现使人衰弱的症状,可能危及生命。KIT蛋白的D816V突变是几乎所有SM疾病的主要驱动因素。目前,还没有已批准的靶向这一突变的疗法上市。
Avapritinib是一种靶向激酶激活构象的1型抑制剂,它能够抑制多种携带KIT和PDGFRA基因突变的蛋白激酶。Blueprint Medicines最初开发avapritinib治疗晚期胃肠道间质瘤(GIST)和晚期SM。2017年6月,avapritinib获得了美国FDA突破性疗法认定,用于治疗携带PDGFRα D842V突变的不可切除或转移性GIST患者。此前,FDA还授予avapritinib孤儿药资格,用于治疗GIST和肥大细胞增多症。基石药业已与Blueprint Medicines达成合作,获得在大中华地区开发avapritinib的权益。
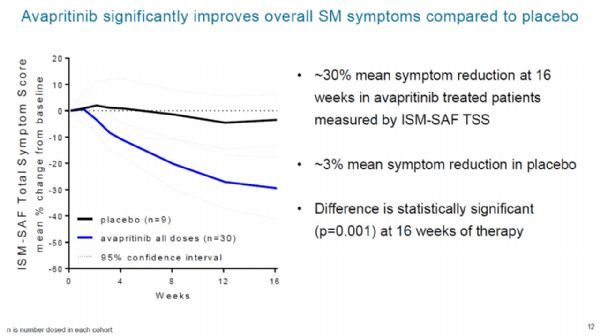
PIONEER是一项随机,双盲,含安慰剂对照组的2期临床试验,旨在评估avapritinib在治疗惰性SM患者中的疗效与安全性。该试验包括三个阶段,分别是:剂量确定阶段,注册试验阶段,和长期治疗阶段。该试验的数据显示,治疗16周后,治疗组中患者的ISM-SAF总症状评分平均下降了约30%,而安慰剂组中患者的这一评分仅下降了3%。25 mg剂量组中患者的血清类胰蛋白酶水平,骨髓肥大细胞和KIT D816V等位基因负荷水平也得到显着的下降。此外,avapritinib的治疗使患者的ISM-SAF皮肤,胃肠道,和神经系统症状都显示出持续的减少,分别减少了37%,25%,和26%。患者的生活质量得分平均改善了34%,而安慰剂组的这一平均得分较基线时提高了7%。
“Avapritinib是专门为抑制KIT的D816V突变体而设计的,旨在为患者提供变革性的临床益处,”Blueprint Medicines首席医学官Andy Boral医学博士说:“这些与安慰剂对照的数据首次显示出对临床结果和生活质量等多种疾病指标的一致性临床改善。这些结果让我们有信心针对该疾病的根源实施治疗,并为SM患者带来更多的临床益处。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。