盘点:2020年1月和2月美国FDA批准的10款创新疗法!
来源:本站原创 2020-02-29 23:57
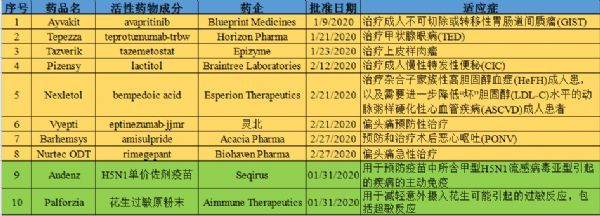
2020年02月29日讯 /生物谷BIOON/ --根据美国食品和药物管理局(FDA)药品评审与研究中心(CDER)的数据统计,在2020年1月和2月,FDA总计批准了8款创新药。而根据FDA生物制剂评审与研究中心(CBER)的数据表明,在2020年1月和2月,FDA还批准了一款食物过敏免疫疗法和一款流感疫苗。以下是对这些创新产品的盘点。1、胃肠道间质瘤(G

2020年02月29日讯 /生物谷BIOON/ --根据美国食品和药物管理局(FDA)药品评审与研究中心(CDER)的数据统计,在2020年1月和2月,FDA总计批准了8款创新药。而根据FDA生物制剂评审与研究中心(CBER)的数据表明,在2020年1月和2月,FDA还批准了一款食物过敏免疫疗法和一款流感疫苗。以下是对这些创新产品的盘点。(点击图片查看大图)
1月9日,FDA批准Blueprint Medicines公司靶向抗癌药Ayvakit(avapritinib),用于治疗携带血小板衍生生长因子受体α(PDGFRA)基因18号外显子突变(包括PDGFRA D842V突变)的不可切除性或转移性胃肠道间质瘤(GIST)成人患者。值得一提的是,Ayvakit是第一个被批准用于GIST的精准疗法,也是唯一一个对PDGFRA基因18号外显子突变型GIST具有高活性的药物。基石药业用于Ayvakit在大中华区的开发与商业化权利。
临床数据显示,在PDGFRA基因18号外显子突变的GIST患者中,Ayvakit治疗的总缓解率(ORR)高达86%(95%CI:69%,93%),且中位缓解持续时间(DOR)尚未达到。GIST是一种罕见的由基因组驱动的胃肠道肉瘤。约6%的新诊断GIST患者具有PDGFRA外显子18突变。最常见的PDGFRA外显子18突变是D842V突变,它对所有其他已批准的疗法都是耐药的。
Ayvakit的活性药物成分为avapritinib,可选择性和强效地抑制KIT和PDGFRA突变激酶。该药是一种I型抑制剂,旨在靶向活性激酶构象;所有致癌激酶都通过这种构象进行信号传导。avapritinib已被证实对胃肠道间质瘤(GIST)相关的KIT和PDGFRA突变具有广泛的抑制作用,包括针对与当前批准疗法耐药相关的激活loop突变的强劲活性。与已批准的多激酶抑制剂相比,avapritinib对KIT和PDGFRA的选择性明显高于其他激酶。
1月21日,FDA批准Horizon Pharma公司单抗药物Tepezza(teprotumumab-trbw),用于治疗甲状腺眼病(TED)。值得一提的是,Tepezza是FDA批准的第一种也是唯一一种治疗TED的药物。
TED是一种严重的、进行性的、威胁视力的罕见自身免疫性疾病,与突眼(眼球膨出)、复视、视力模糊、疼痛、炎症和面部缺陷相关。Tepezza是一种全人单克隆抗体和胰岛素样生长因子-1受体(IGF-1R)靶向制剂,每三周注射一次,共注射8次。
在III期OPTIC研究中,与安慰剂组相比,teprotumumab治疗组患者眼球突出或鼓胀表现出显著改善,达到了主要终点:teprotumumab治疗组有82.9%的患者达到眼球突出或鼓胀减少2mm或更多的主要终点,而安慰剂组仅为9.5%,数据具有统计学显著差异(p<0.001)。眼球突出(proptosis)是TED患者发病的主要原因。此外,该研究也达到了全部次要终点,包括复视减少、生活质量改善、临床活动评分降低。该研究中,teprotumumab的耐受性良好,大多数不良事件是轻度或中度,在治疗期间或治疗后可以控制和解决。来自II期研究的数据显示,teprotumumab治疗使眼球突出和活动性TED症状(疼痛、肿胀、红肿、炎症)取得临床意义和高度统计学意义的减少。
1月23日,FDA批准Epizyme公司表观遗传学药物Tazverik(tazemetostat),用于治疗16岁及以上、不符合完全切除条件的转移性或局部晚期上皮样肉瘤(ES)儿科和成人患者。值得一提的是,Tazverik是获美国FDA批准的第一个也是唯一一个EZH2抑制剂,也是该机构批准专门针对ES患者的第一个也是唯一一个疗法。
Tazverik的活性药物成分tazemetostat是一种口服、强效、首创(first-in-class)、EZH2抑制剂。EZH2是一种组蛋白甲基转移酶,如被异常激活,将导致控制细胞增殖的基因失调,从而可引起非霍奇金淋巴瘤(NHL)及其他多种实体瘤细胞的无限制迅速生长。tazemetostat可通过抑制EZH2酶活性而发挥抗肿瘤作用。在临床研究中,tazemetostat在治疗早期就表现出了安全有效地缩小甚至消除肿瘤的能力。
目前,Tazverik还有一份新药申请(NDA)正在接受FDA的优先审查,用于治疗先前已接受过至少2种系统疗法的复发或难治性滤泡性淋巴瘤(R/R FL)患者。II期研究数据显示,在EZH2突变FL患者、野生型EZH2 FL患者中,Tazverik治疗的总缓解率(ORR)分别为69%、35%。当前,滤泡性淋巴瘤(FL)仍然是一种毁灭性的不治之症。如果获批准,Tazverik将为携带或不携带EZH2激活突变的FL患者群体带来一种新的治疗选择。
【4】慢性特发性便秘(CIC)新药!Braintree公司口服乳糖醇疗法Pizensy获美国FDA批准!
2月12日,FDA批准Braintree Laboratories公司便秘新药Pizensy(lactitol,乳糖醇),用于成人治疗慢性特发性便秘(CIC)。CIC是一种常见疾病,主要症状是长期排便困难和不频繁,其它症状还包括腹痛和腹胀。特发性是指引起便秘的原因不明。
Pizensy是一种渗透性泻药,通过口服给药,其活性药物成分为乳糖醇,具有渗透作用,可促进水分流入小肠,进而在结肠内达到通便作用。
Pizensy经口给药后的系统性吸收很低,在小肠内不会被吸收,在结肠内被转化为有机酸,平均半衰期为2.4小时。临床数据显示,与安慰剂组相比,Pizensy治疗组有更高比例的患者每周完全自发排便(CSBM)次数增加到至少3次(25% vs 13%;差异=12%)。
2月21日,FDA批准Esperion Therapeutics公司降胆固醇新药Nexletol(bempedoic acid,片剂),这是一种口服、每日一次的、非他汀类、降低LDL-C的药物,具体适应症为:作为饮食和最大耐受剂量他汀类药物的辅助疗法,用于治疗杂合子家族性高胆固醇血症(HeFH)成人患,以及需要进一步降低“坏”胆固醇(LDL-C)水平的动脉粥样硬化性心血管疾病(ASCVD)成人患者。
值得一提的是,Nexletol是近20年来在美国批准的第一种口服、每日一次、非他汀类降胆固醇药物,在降低LDL-C方面具有一种全新的作用机制。该药活性药物成分bempedoic acid是一种首创(first-in-class)ATP柠檬酸裂解酶(ACL)抑制剂,通过降低胆固醇生物合成和上调LDL受体来降低LDL-C。bempedoic acid在骨骼肌中不会被激活,可避免他汀类药物相关的肌肉毒性。
III期临床数据显示,当与最大耐受剂量他汀类药物联合用药时,与安慰剂相比,Nexletol将LDL-C水平降低18%。在他汀类药物不耐受的患者中,与安慰剂相比,Nexletol将LDL-C水平降低28%。此外,Nexletol还将高敏C反应蛋白(Hs-CRP)水平相对基线降低19%-22%,这是心血管疾病相关炎症的关键标志物。
2月21日,FDA批准灵北(Lundbeck)单抗药物Vyepti(eptinezumab-jjmr),用于预防性治疗成人偏头痛。值得一提的是,Vyepti是FDA批准的首个用于预防偏头痛的静脉(IV)疗法,该药通过静脉输注给药,推荐剂量为每季度(3个月)一次100mg,部分患者可能受益于300mg剂量。
Vyepti的活性药物成分eptinezumab是一种人源化IgG1单克隆抗体,靶向结合降钙素相关基因肽(CGRP)配体,阻断其对受体的结合作用。CGRP是一种神经肽,已被证明在偏头痛发作时释放,可能是偏头痛发作的诱因。目前,CGRP及其受体已成为偏头痛药物研发的热门靶点。临床数据,2种剂量(100mg,300mg)Vyepti在静脉输注后第一天就显示出治疗益处,许多患者偏头痛天数至少可以减少75%,在治疗6个月期间偏头痛持续改善。
偏头痛是全球第三大最常见疾病和第六大致残性疾病,这是一种常见的慢性神经血管性疾病,特征为反复发作的剧烈头痛,多为偏侧。据估计,在全球范围内,偏头痛患者总数超过10亿人。世界卫生组织(WHO)已将偏头痛列为10大最致残疾病之一,与其他人群相比,偏头痛患者更可能发生抑郁、焦虑、睡眠障碍、其他疼痛及疲劳。目前,尚没有药物能够治愈偏头痛。
2月27日,FDA批准Acacia制药集团Barhemsys(amisulpride injection,氨磺必利注射剂),用于成人患者,预防和治疗术后恶心呕吐(PONV)。该批准涵盖了已使用一种不同类别的止吐药预防性治疗PONV的手术患者或没有接受止吐药预防性治疗PONV的手术患者,以及单独使用或与不同类别的止吐药联合使用预防PONV。
值得一提的是,在接受当前标准护理预防性治疗PONV失败的患者中,Barhemsys是第一个也是唯一一个被批准用于抢救性治疗PONV的止吐药。此外,Barhemsys也被批准用于预防PONV,单独使用或与不同类别的止吐药联合使用。Barhemsys是氨磺必利(amisulpride)的静脉制剂(2.5mg/mL),氨磺必利是一种选择性多巴胺D2和D3受体拮抗剂,片剂产品已在全球多个国家上市销售,用于治疗精神分裂症。
在手术患者中,PONV仍然是一个重大问题,过去20年里进展甚微。PONV常被患者认为是手术中最不受欢迎的并发症,甚至比疼痛还要严重。目前,PONV主要为预防性治疗,而对于预防性治疗失败的患者,尚无批准的有效抢救性治疗方案。在美国,据估计每年有1600万手术患者尽管接受了标准预防性治疗仍会发生PONV,Barhemsys将成为这类患者群体的新护理标准。
【8】首个口腔崩解CGRP受体拮抗剂偏头痛药物!美国FDA批准Nurtec ODT用于急性治疗,速效持久!
2月27日,FDA批准Biohaven公司药物Nurtec ODT(rimegepant),用于成人偏头痛(有或无先兆)急性治疗。该药可在口腔内崩解分散,不需要水,可以非常方便的、随时随地服用。Nurtec ODT将为偏头痛患者提供一种重要的、新的口服急性治疗药物,能迅速减轻和消除疼痛、恢复生活。
值得一提的是,Nurtec ODT是首个也是唯一一个获FDA批准的速效口腔崩解片(ODT)剂型的降钙素基因相关肽(CGRP)受体拮抗剂。在临床研究中,单次口服Nurtec ODT 75mg,可在1小时内迅速缓解疼痛,恢复正常功能,对许多患者的持续疗效可达48小时;此外,接受单剂量Nurtec ODT治疗的患者中,高达86%的患者在24小时内没有使用偏头痛抢救药物。
当前,有数百万偏头痛患者常常对其目前的急性治疗不满意,因为麻烦的副作用和功能下降,有时不得不做出重大的权衡。Nurtec ODT具有新颖的快速溶解口服片剂剂型,可帮助患者随时随地从容应对偏头痛急性发作。该药通过阻断CGRP受体发挥作用,治疗偏头痛的根本原因。Nurtec ODT不是阿片类药物或麻醉剂,不具有成瘾性,也不被美国禁毒局列为管制药物。医药市场调研机构EvaluatePharma预测,Zydis ODT在2024年的销售额将达到8.97亿美元,成为全球最畅销的偏头痛急性治疗药物。
1月31日,FDA批准Seqirus公司疫苗产品Audenz(甲型流感[H5N1]单价疫苗,佐剂),用于6个月及以上的人群的主动免疫,帮助保护免受甲型流感(H5N1)的侵害。值得一提的是,Audenz是旨在用于大流行时预防甲型H5N1流感的首个佐剂、基于细胞的流感疫苗。
Audenz是一种新型疫苗,结合了两种前沿技术——MF59佐剂和基于细胞的抗原制造。该疫苗旨在迅速部署以保护美国民众,并可储备以应对流感大流行。MF59佐剂是大流行预防计划的重要组成部分,因为它减少了产生免疫应答所需的抗原量、增加了疫苗研制的剂量,以便尽快保护大量的人群。
流感大流行是由一种新的流感病毒引起的全球性流行病,在人类中几乎没有或没有预先存在的免疫力。大流行病是不可能预测的,并且可能在全球造成灾难性的发病率和死亡率。世界卫生组织(WHO)2019-2030年全球流感战略指出严重的流行病可造成广泛的社会和经济影响,包括国家经济生产力的丧失和受影响公民和社区的严重经济负担。
1月31日,FDA批准Aimmune Therapeutics公司花生过敏免疫疗法Palforzia(花生过敏原粉剂-dnfp,开发代码:AR101)。Palforzia是一种口服免疫疗法(OIT),用于确诊为花生过敏的患者,减轻意外摄入花生后可能发生的过敏反应,包括严重过敏反应。值得一提的是,Palforzia是全球首个获批用于治疗花生过敏的疗法,同时也是全球首个获批用于治疗任何食物过敏的疗法。
花生过敏是全球最常见的食物过敏之一,仅在美国,就有超过160万儿童和青少年对花生过敏。一直以来,针对花生过敏儿童和青少年的标准护理都是严格的花生排除饮食(elimination diet),以及在意外摄入花生引起过敏反应时及时给予救援药物。尽管保持高警惕性,但仍可能发生意外摄入花生,导致严重程度不可预测的过敏反应,以及导致严重过敏反应的终身风险。
Palforzia是采用Aimmune公司专有的口服脱敏免疫疗法(CODIT)治疗平台开发的首个产品,该平台旨在利用明确的、精确数量的关键过敏原使患者脱敏,从而针对因意外摄入食物过敏原所致的免疫反应提供有意义的保护水平。Palforzia由从花生中提取的关键过敏原组成、是一种成分固定的粉末,包装于可拉开的彩色编码胶囊中(用于剂量递增和加药)和小袋(300mg/袋,用于维持治疗)。用药时,将粉末从胶囊或小袋中取出,与少量半固体食物(如苹果酱、酸奶或布丁)混合,然后食用。
花生过敏是一个价值30亿美元的市场。作为首个治疗花生过敏的药物,业界对Palforzia的商业前景非常看好。医药市场调研机构EvaluatePharma此前预测,Palforzia在2024年的销售额有望达到17.5亿美元。(生物谷Bioon.com)
原文出处:FDA新药数据库、生物谷
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->