2020年2月Science期刊不得不看的亮点研究
来源:本站原创 2020-02-29 23:59
2020年2月29日讯/生物谷BIOON/---2020年2月份即将结束了,2月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Science:经过CRISPR基因编辑的CAR-T细胞在癌症患者体内是安全的doi:10.1126/science.aba7365; doi:10.1126/science.aba9844在一项
2020年2月29日讯/生物谷BIOON/---2020年2月份即将结束了,2月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:经过CRISPR基因编辑的CAR-T细胞在癌症患者体内是安全的
doi:10.1126/science.aba7365; doi:10.1126/science.aba9844
在一项新的研究中,来自美国宾夕法尼亚大学和斯坦福大学的研究人员将两种最先进的方法---CRISPR(对DNA进行编辑)和T细胞疗法(利用免疫系统的哨兵破坏肿瘤)---结合在一起,从而在快速发展的癌症免疫疗法领域开创了新的篇章。他们报道两名女性和一名男性,年龄都在60多年,其中的一人患有肉瘤,剩余两人患有一种称为多发性骨髓瘤的血癌。这三名患者在去年接受了他们自身的经过CRISPR基因编辑的免疫细胞治疗。相关研究结果于2019年2月6日在线发表在Science期刊上,论文标题为“CRISPR-engineered T cells in patients with refractory cancer”。
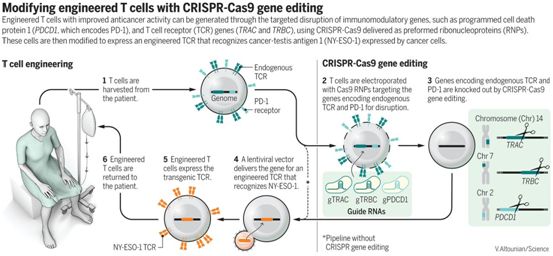
对这三名患者来说,益处是有限的:一人已经死亡,而另外两人的病情已经恶化。但是,论文通讯作者、宾夕法尼亚大学癌症研究员Carl June说,这项经过多年监管审查的临床试验并不是为了治愈癌症,相反,它的目标是表明这种策略是可行的和安全的。
这些研究人员先是寻找那些所患的肿瘤产生一种名为NY-ESO-1的蛋白的患者,以便将一个编码靶向这种蛋白的基因添加到从这些患者体内提取出的T细胞中。这些患者也需要携带一种特定类型的人类白细胞抗原(HLA),HLA是一种免疫蛋白复合物,有助于灌注回患者体内的T细胞茁壮成长。符合条件的四名患者都病得很重,这是这种新疗法经常遇到的情形。一名患有多发性骨髓瘤的女性患者接受了三次骨髓移植。另一名在三十多岁时患上肉瘤的女性患者病情太重无法接受她的在实验室中经过基因改造的T细胞治疗,她接受临床关怀,死了。
为了促进来自这些患者的T细胞抵抗他们所患的疾病,这些研究人员使用CRISPR敲除了两个编码所谓T细胞受体(TCR)的基因。此外,他们还削弱了第三个基因,它编码一种称为PD-1的蛋白。他们推测,PD-1可以阻止免疫反应,清除PD-1的影响可能会丰富T细胞的功能。随后,他们将一个不同的靶向NY-ESO-1的T细胞受体编码基因插入到T细胞中。
对这三名患者的密集监测,包括抽血以研究他们体内的经过基因改造的T细胞,结果证实了CRISPR会导致一些脱靶变化。但是它们很少,而且具有这些意想不到的DNA变化的细胞数量会随着时间的推移逐渐消失。令人鼓舞的是,这些经过CRISPR基因编辑的T细胞可在体内持续至少9个月的时间,而现有的CAR-T细胞疗法研究中,这一数字为大约2个月。影像学检查显示出“良好的健康的T细胞”,在实验室研究中,它们在输注回患者体内几个月后就可以击退癌症。
但在这三名患者中,预后却不高。最好的反应是在一名肉瘤患者体内观察到的,他的原发性肿瘤缩小了,不过他的癌症后来又恶化了。这些研究人员提出了可能的原因,包括接受治疗的患者人数较少,以NY-ESO-1为靶标可能存在局限性(选择它作为靶标部分上是出于它具有较好的安全记录)以及未能在许多T细胞中敲除全部的三个基因。
2.Science:构建首个人类胸腺细胞图谱,揭示人类免疫系统起源,为开发新型癌症免疫疗法打开大门
doi:10.1126/science.aay3224
人类胸腺的首个细胞图谱可能会导致新的免疫疗法来治疗癌症和自身免疫疾病。如今,在一项新的研究中,来自英国纽卡斯尔大学、韦尔科姆基金会桑格研究所和比利时根特大学等研究机构的研究人员绘制出胸腺组织在人类一生中的图谱,以了解它如何发育和产生重要 的称为T细胞的免疫细胞。在未来,这些信息可能有助于科学家们构建出人造胸腺和设计改进的治疗性T细胞。相关研究结果发表在2020年2月21日的Science期刊上,论文标题为“A cell atlas of human thymic development defines T cell repertoire formation”。
这些研究人员使用单细胞技术从发育中的胸腺以及儿童和成人的胸腺组织中分离并分析了约20万个细胞。他们研究了每个细胞中有活性的基因以鉴定这些细胞,结果发现了新的细胞类型,并使用这些基因作为标志物将每个细胞对应到胸腺中的确切位置。
论文第一位作者、韦尔科姆基金会桑格研究所的Jongeun Park博士说,“我们绘制出首个人类胸腺细胞图谱,以了解从发育到成年的整个生命周期中健康胸腺所发生的情况以及它如何为支持T细胞形成提供理想的环境。这种公开可获得的资源将使得全世界的科学家们能够 了解免疫系统如何发育来保护我们的身体。”
3.Science:遗传研究揭示脊椎动物延缓衰老的新线索
doi:10.1126/science.aaw2601; doi:10.1126/science.aba8064
在一项新的研究中,来自美国斯坦福大学、斯托瓦斯医学研究所和加拿大英属哥伦比亚大学的研究人员发现了关于非洲青鳉鱼(African turquoise killifish)在滞育(diapause)期间如何能够暂停衰老过程的线索。相关研究结果发表在2020年2月21日的Science期刊上 ,论文标题为“Vertebrate diapause preserves organisms long term through Polycomb complex members”。他们在这篇论文中描述了他们对这种鱼的遗传分析以及从中了解到的信息。美国华盛顿大学的Marc Van Gilst在同期Science期刊上针对这项研究发表了一篇 标题为“A time to grow and a time to pause”的观点(Perspective)类型论文。
非洲青鳉鱼是少数几种能够让自己在一段时间内处于类似假死的状态以便在恶劣的环境下生存下来的生物之一,但仅当它们还是胚胎的时候才能做到这一点。这种青鳉鱼生活在莫桑比克和津巴布韦的池塘中,这些池塘会定期变干,有时会一次几个月或几年保持干燥。为 了在这样的环境中生存下来,它们已进化出必要时滞育的能力。先前的研究已表明这样做可以让这种青鳉鱼将衰老过程暂停数月甚至数年。当雨季来临时,池塘里充满了水,这种青鳉鱼退出滞育状态,发育成熟并像成年鱼一样生活几个月,但是尚不清楚它们是如何做到 这一点的。
在这项新的研究中,这些研究人员对青鳉鱼胚胎进行了遗传研究,从而揭示出一些线索。数据显示,许多参与细胞生长和器官发育的细胞暂时停止发挥作用,而其他细胞(比如负责产生阻止肌肉退化的蛋白的细胞)继续发挥作用,其结果是青鳉鱼胚胎的代谢在滞育期间 处于暂停状态。
4.Science:复旦大学联合哈佛医学院开发广谱流感疫苗佐剂
doi:10.1126/science.aau0810; doi:10.1126/science.aba2754
I型干扰素(IFN-Is)是保护性免疫的主要免疫介导者,能有效对抗感染;可以由流感病毒感染的肺泡上皮细胞(AECs)和免疫细胞激活产生。因此,这两种细胞干扰素基因刺激因子 (STING)的激活可以诱导由感染病毒或者疫苗所激起的免疫反。然而,在不破坏肺泡表面活性 剂层(PS)的情况下将STING激活剂输送到AECs的细胞质极具挑战,因为PS层形成了一个强大的屏障,可以阻止纳米颗粒还有亲水分子穿过。
近日来自哈佛医学院麻省总医院Mei X Wu副教授联合复旦大学陆路、姜世勃团队开发了一种安全有效的PS仿生纳米颗粒(PS-GAMP),能够促进流感疫苗激活产生抵抗异种亚型流感病毒的广谱性免疫反应,相关研究成果于2月21日发表在《Science》上,题为"Pulmonary surfactant-biomimetic nanoparticles potentiate heterosubtypic influenza immunity"。
研究人员合成了仿生PS的脂质体包载了cGAMP形成了一种新型佐剂,这种佐剂(PS-GAMP)可有效增强流感疫苗诱导模拟无病毒感染的早期阶段的小鼠产生体液免疫反应和CD8+ T细胞的免疫反应,同时不会产生过度炎症。经鼻内注射PS-GAMP佐剂和H1N1疫苗2天后,小鼠可以 对H1N1、H3N2、H5N1和H7N9病毒保持至少6个月的交叉保护,同时还可以保持肺记忆CD8+ T细胞。随后研究人员在雪貂中验证了其佐剂效应。研究人员发现当肺泡上皮细胞(AECs)缺乏sting基因或间隙连接被抑制时,PS-GAMP介导的调节作用被大大消除。总的而言,本研究 发现AECs在诱导异型免疫中起着关键作用,而研究人员开发的PS-cGAMP可以作为一种广谱佐剂对抗多种流感。
5.Science:揭示一种奇怪的海洋动物在一生当中都可产生卵子和精子之谜
doi:10.1126/science.aay6782
一种鲜为人知的海洋生物通常生长在死的寄居蟹的蟹壳上,这听起来似乎不太可能成为科学家们的研究对象,但这种动物有一种罕见的能力,它可以在一生中制造卵子和精子。这种称为贝螅(Hydractinia)的动物之所以能够做到这一点,是因为它会产生生殖细胞---卵子和精子的前体细胞,而且在整个生命过程中都不会停止。研究这种独特的能力可能为人类生殖系统发育和人类生殖相关疾病的形成提供新的见解。
在一项新的研究中,来自美国国家人类基因组研究所、佛罗里达大学和爱尔兰国立高威大学的研究人员报道贝螅成体干细胞中的Tfap2基因激活可以将这些干细胞转化为生殖细胞,并且这一个过程可以不断重复。相关研究结果发表在2020年2月14日的Science期刊上,论文标题为“Transcription factor AP2 controls cnidarian germ cell induction”。
论文共同作者、美国国家人类基因组研究所计算基因组学部主任Andy Baxevanis博士说,“通过测序和研究在实验室中更易于操作的简单生物的基因组,我们能够梳理出有关决定生殖细胞命运的生物学基础的重要见解,这些知识最终可能有助于我们更好地理解人类生殖障碍的潜在过程。”
6.Science:从结构上揭示INSTI药物结合HIV整合体机制
doi:10.1126/science.aay8015
在一项新的研究中,来自美国国家糖尿病与消化疾病研究所、美国国家癌症研究所、沙克生物研究所和斯克里普斯研究所的研究人员发现了一类强大的HIV药物如何结合HIV整合体(intasome)的一个关键部分。通过首次解析出这种整合体与不同药物结合在一起时的三维结构,他们发现了是什么让这类药物如此有效。这项研究提供了可能有助于设计或改进HIV新疗法的重要见解。相关研究结果近期发表在Science期刊上,论文标题为“Structural basis for strand transfer inhibitor binding to HIV intasomes”。

HIV整合体是这种病毒感染的一种关键结构,它由HIV蛋白整合酶(integrase)和病毒DNA链组成,而且是在这种病毒入侵人细胞时形成的。这种整合体进入人细胞,随后进行必要的化学反应,从而将这种病毒的遗传物质整合到人DNA中。一些称为整合酶链转移抑制剂(integrase strand transfer inhibitor, INSTI)的药物成功地阻断这种整合体;当它不能将病毒DNA整合到人类基因组中时,HIV就不能够感染人细胞。目前,有四种INSTI药物获得美国食品药物管理局(FDA)的批准,还有一些正在开发当中。
在这项新的研究中,Lyumkis的研究团队获得了HIV整合体被四种INSTI---市售药物bictegravir;三种称为4f、4d和4c 的实验性化合物---之一阻断时的结构。他们使用了倾斜单粒子低温电子显微镜(single-particle cryo-electron microscopy(他们帮助优化的一种成像技术)来揭示每种HIV整合体-药物复合物的结构。
Lyumkis的第一个观察结果是,这些药物与HIV整合体结合在一起时与它们与PFV整合体结合在一起时有何不同。比如,化合物4f在与PFV整合体结合时会回环到它自身上,而在与HIV整合体结合时却保持相对平坦,这些细节可以帮助人们改善潜在的未来分子的结合特性。
7.Science:HIV耐药性机制新见解
doi:10.1126/science.aay4919
如今,已有许多有助于控制HIV感染的药物,包括整合酶链转移抑制剂在内。该药物家族中有四种药物:raltegravir,elvitegravir,dolutegravir和bictegravir。它们都通过与HIV的一种被称为整合酶的关键酶类结合而起作用,以阻止其将病毒的遗传物质插入人体细胞的DNA中。尽管最初非常有效,但随着时间的流逝,HIV会对这些药物产生抵抗力。
近日,Dana-Farber癌症研究所的研究揭示了HIV对多种药物产生耐药性的机制,这一发现为开发更有效的治疗方法打开了大门。这项研究于2020年1月30日在《Science》杂志上在线发表,该研究发现了HIV产生药物耐药性的机制。尽管这些药物通常在结合和阻断整合酶方面非常有效,但随着时间的流逝,病毒会削弱药物的能力,从而使HIV再次起作用。
“我们的结构生物学方面的研究使得我们能够看到药物与病毒酶活性位点的精确结构。这一结构将为设计更有效的整合酶抑制剂提供参考,从而可以改善数百万HIV感染者的生活。”美国Dana-Farber癌症研究所癌症免疫学和病毒学教授Alan Engelman说。
8.Science:浙大科学家揭示小胶质细胞在记忆调节中起着关键作用
doi:10.1126/science.aaz2288
小胶质细胞是大脑中的常驻免疫细胞,它们是第一反应者,总是在寻找发生差错的地方。它们大约占我们脑细胞的10%。在过去,它们被认为是大脑中的被动旁观者,仅在受伤或感染时,它们才起作用。这些细胞最早是由德国医生Rudolf Virchow于1856年观察到的,后来被称为小胶质细胞,意为“小胶水”。
如今,在一项新的以小鼠为实验对象的研究中,来自中国浙江大学医学院的研究人员发现小胶质细胞实际上可能是记忆保持的关键因素。如果在人类中发现同样的效果,那么这可能导致人们开发出更好地治疗健忘症、阿尔茨海默病和其他影响记忆力的疾病的方法。相关研究结果发表在2020年2月7日的Science期刊上,论文标题为“Microglia mediate forgetting via complement-dependent synaptic elimination”。
这项新研究表明小胶质细胞与小鼠的记忆保持密切相关。小鼠经历了恐惧条件反射fear conditioning)任务,使得当将它们放置在它们记得经历过一些负面事情—在这项研究中,指的是对它们的脚施加较小的电击---的环境中时,它们会因恐惧而呆立不动。
在35天的时间内,小鼠的僵直反应(freezing response)从70%降低到20%,这表明它们已经忘记了这种特定环境的负面影响。然后,这些作者使用了一系列科学工具,包括遗传、药理和生化方法,移除这些小鼠大脑中的小胶质细胞,并再次进行了实验。
实验结果表明,移除小胶质细胞改变了它们对这个任务的反应。大约50%的小鼠(在上述实验中,这一比例为20%)即使在类似的一段时间后仍记得这种负面经历。基于此,提出的一种假设是小胶质细胞是巩固这些记忆以及支持哪些记忆被遗忘和哪些记忆被保持的关键。这项研究继续发现,正是这些小鼠内部的突触重新排列才导致了这一观察结果。
9.Science:颠覆常规!揭示蚊子找到人类来叮咬的新机制
doi:10.1126/science.aay9847; doi:10.1126/science.aba4484
在一项新的研究中,美国布兰戴斯大学生物学教授Paul Garrity、博士生Chloe Greppi、博士后研究员Willem Laursen和其他几位同事报道,他们发现了蚊子如何利用人类体温来寻找和叮咬 人类的一个重要方面。相关研究结果发表在2020年2月7日的Science期刊上,论文标题为“Mosquito heat seeking is driven by an ancestral cooling receptor”。

在实验中,这些研究人员敲除了负责产生IR21a受体的蚊子基因。然后,他们将大约60只突变蚊子(即基因敲除蚊子)放入一个鞋盒大小的容器中,在这个容器的后壁上装有一块板,将这块板 加热到接近37℃的核心体温,然后向这些蚊子喷入一小撮二氧化碳,以模仿人类的呼吸。当非突变蚊子快速地聚集在这块接近37℃的板上试图觅食时,突变蚊子很大程度上忽略了这块板。在 没有IR21a受体的情形下,它们将无法再将自己引向附近最热的地方。
在第二个实验中,将这些蚊子放在一个小网眼笼子中。这些研究人员在这个笼子上方放置了两个充满人类血液的小瓶,其中一个加热到22.78℃(室温),另一个加热到31.1℃(人手的表面温 度)。相比于处于相同环境下的非突变蚊子,突变蚊子对31.1℃血液的偏好降低了。
根据Garrity的说法,每当蚊子向较低温度移动时,IR21a受体就会被激活。由于人类通常比周围环境温暖,这意味着在蚊子接近人类时,IR21a保持沉默。但是,如果蚊子偏离路线并开始远离 它的温血猎物,那么IR21a会被激活,只有在蚊子改道后它才会关闭。
10.Science:细胞间通讯如何导致白血病发生?
doi:10.1126/science.aaw3242
近日,发表在《Science》杂志上的一项新的研究揭示了血液干细胞中的“流氓“通讯如何导致白血病的发生。这一发现为开发阻止该过程的新靶向治疗铺平道路。
当干细胞突变导致它们产生过多的血细胞时,就会发生诸如白血病之类的血液癌症。对此,来自约克大学的研究人员揭示了这些突变如何使细胞偏离其正常的相互通讯轨道,从而促使血细胞 的发育失控。
在这一研究中,科学家使用超分辨率荧光显微镜来研究血液干细胞彼此之间实时对话的方式。他们观察了细胞是如何从“信号蛋白”接收指令。该信号蛋白会与另一细胞表面的受体结合,然 后传递信号告知细胞如何响应。进一步,研究人员发现与某些类型血液癌症相关的突变会导致血液干细胞变得“无赖”,即在没有细胞因子的情况下仍能够进行交流。
约克大学生物医学研究所和约克大学生物系的伊恩·希区柯克教授说:“我们的身体每天通过相互之间的信号传递产生数十亿个血细胞。细胞因子的作用就像工厂的监督员一样,调节这一过 程并控制不同血细胞类型的发育和增殖。我们的研究揭示了一个以前未知的机制,即细胞发生突变后如何导致其在不受细胞因子的调控下发生信号传导,从而导致白血病等血液癌症的发生。 了解这种机制有助于新药的开发。”
1.Science:经过CRISPR基因编辑的CAR-T细胞在癌症患者体内是安全的
doi:10.1126/science.aba7365; doi:10.1126/science.aba9844
在一项新的研究中,来自美国宾夕法尼亚大学和斯坦福大学的研究人员将两种最先进的方法---CRISPR(对DNA进行编辑)和T细胞疗法(利用免疫系统的哨兵破坏肿瘤)---结合在一起,从而在快速发展的癌症免疫疗法领域开创了新的篇章。他们报道两名女性和一名男性,年龄都在60多年,其中的一人患有肉瘤,剩余两人患有一种称为多发性骨髓瘤的血癌。这三名患者在去年接受了他们自身的经过CRISPR基因编辑的免疫细胞治疗。相关研究结果于2019年2月6日在线发表在Science期刊上,论文标题为“CRISPR-engineered T cells in patients with refractory cancer”。

图片来自Science, 2020, doi:10.1126/science.aba9844。
对这三名患者来说,益处是有限的:一人已经死亡,而另外两人的病情已经恶化。但是,论文通讯作者、宾夕法尼亚大学癌症研究员Carl June说,这项经过多年监管审查的临床试验并不是为了治愈癌症,相反,它的目标是表明这种策略是可行的和安全的。
这些研究人员先是寻找那些所患的肿瘤产生一种名为NY-ESO-1的蛋白的患者,以便将一个编码靶向这种蛋白的基因添加到从这些患者体内提取出的T细胞中。这些患者也需要携带一种特定类型的人类白细胞抗原(HLA),HLA是一种免疫蛋白复合物,有助于灌注回患者体内的T细胞茁壮成长。符合条件的四名患者都病得很重,这是这种新疗法经常遇到的情形。一名患有多发性骨髓瘤的女性患者接受了三次骨髓移植。另一名在三十多岁时患上肉瘤的女性患者病情太重无法接受她的在实验室中经过基因改造的T细胞治疗,她接受临床关怀,死了。
为了促进来自这些患者的T细胞抵抗他们所患的疾病,这些研究人员使用CRISPR敲除了两个编码所谓T细胞受体(TCR)的基因。此外,他们还削弱了第三个基因,它编码一种称为PD-1的蛋白。他们推测,PD-1可以阻止免疫反应,清除PD-1的影响可能会丰富T细胞的功能。随后,他们将一个不同的靶向NY-ESO-1的T细胞受体编码基因插入到T细胞中。
对这三名患者的密集监测,包括抽血以研究他们体内的经过基因改造的T细胞,结果证实了CRISPR会导致一些脱靶变化。但是它们很少,而且具有这些意想不到的DNA变化的细胞数量会随着时间的推移逐渐消失。令人鼓舞的是,这些经过CRISPR基因编辑的T细胞可在体内持续至少9个月的时间,而现有的CAR-T细胞疗法研究中,这一数字为大约2个月。影像学检查显示出“良好的健康的T细胞”,在实验室研究中,它们在输注回患者体内几个月后就可以击退癌症。
但在这三名患者中,预后却不高。最好的反应是在一名肉瘤患者体内观察到的,他的原发性肿瘤缩小了,不过他的癌症后来又恶化了。这些研究人员提出了可能的原因,包括接受治疗的患者人数较少,以NY-ESO-1为靶标可能存在局限性(选择它作为靶标部分上是出于它具有较好的安全记录)以及未能在许多T细胞中敲除全部的三个基因。
2.Science:构建首个人类胸腺细胞图谱,揭示人类免疫系统起源,为开发新型癌症免疫疗法打开大门
doi:10.1126/science.aay3224
人类胸腺的首个细胞图谱可能会导致新的免疫疗法来治疗癌症和自身免疫疾病。如今,在一项新的研究中,来自英国纽卡斯尔大学、韦尔科姆基金会桑格研究所和比利时根特大学等研究机构的研究人员绘制出胸腺组织在人类一生中的图谱,以了解它如何发育和产生重要 的称为T细胞的免疫细胞。在未来,这些信息可能有助于科学家们构建出人造胸腺和设计改进的治疗性T细胞。相关研究结果发表在2020年2月21日的Science期刊上,论文标题为“A cell atlas of human thymic development defines T cell repertoire formation”。
这些研究人员使用单细胞技术从发育中的胸腺以及儿童和成人的胸腺组织中分离并分析了约20万个细胞。他们研究了每个细胞中有活性的基因以鉴定这些细胞,结果发现了新的细胞类型,并使用这些基因作为标志物将每个细胞对应到胸腺中的确切位置。
论文第一位作者、韦尔科姆基金会桑格研究所的Jongeun Park博士说,“我们绘制出首个人类胸腺细胞图谱,以了解从发育到成年的整个生命周期中健康胸腺所发生的情况以及它如何为支持T细胞形成提供理想的环境。这种公开可获得的资源将使得全世界的科学家们能够 了解免疫系统如何发育来保护我们的身体。”
3.Science:遗传研究揭示脊椎动物延缓衰老的新线索
doi:10.1126/science.aaw2601; doi:10.1126/science.aba8064
在一项新的研究中,来自美国斯坦福大学、斯托瓦斯医学研究所和加拿大英属哥伦比亚大学的研究人员发现了关于非洲青鳉鱼(African turquoise killifish)在滞育(diapause)期间如何能够暂停衰老过程的线索。相关研究结果发表在2020年2月21日的Science期刊上 ,论文标题为“Vertebrate diapause preserves organisms long term through Polycomb complex members”。他们在这篇论文中描述了他们对这种鱼的遗传分析以及从中了解到的信息。美国华盛顿大学的Marc Van Gilst在同期Science期刊上针对这项研究发表了一篇 标题为“A time to grow and a time to pause”的观点(Perspective)类型论文。

图片来自Science, 2020, doi:10.1126/science.aaw2601。
非洲青鳉鱼是少数几种能够让自己在一段时间内处于类似假死的状态以便在恶劣的环境下生存下来的生物之一,但仅当它们还是胚胎的时候才能做到这一点。这种青鳉鱼生活在莫桑比克和津巴布韦的池塘中,这些池塘会定期变干,有时会一次几个月或几年保持干燥。为 了在这样的环境中生存下来,它们已进化出必要时滞育的能力。先前的研究已表明这样做可以让这种青鳉鱼将衰老过程暂停数月甚至数年。当雨季来临时,池塘里充满了水,这种青鳉鱼退出滞育状态,发育成熟并像成年鱼一样生活几个月,但是尚不清楚它们是如何做到 这一点的。
在这项新的研究中,这些研究人员对青鳉鱼胚胎进行了遗传研究,从而揭示出一些线索。数据显示,许多参与细胞生长和器官发育的细胞暂时停止发挥作用,而其他细胞(比如负责产生阻止肌肉退化的蛋白的细胞)继续发挥作用,其结果是青鳉鱼胚胎的代谢在滞育期间 处于暂停状态。
4.Science:复旦大学联合哈佛医学院开发广谱流感疫苗佐剂
doi:10.1126/science.aau0810; doi:10.1126/science.aba2754
I型干扰素(IFN-Is)是保护性免疫的主要免疫介导者,能有效对抗感染;可以由流感病毒感染的肺泡上皮细胞(AECs)和免疫细胞激活产生。因此,这两种细胞干扰素基因刺激因子 (STING)的激活可以诱导由感染病毒或者疫苗所激起的免疫反。然而,在不破坏肺泡表面活性 剂层(PS)的情况下将STING激活剂输送到AECs的细胞质极具挑战,因为PS层形成了一个强大的屏障,可以阻止纳米颗粒还有亲水分子穿过。
近日来自哈佛医学院麻省总医院Mei X Wu副教授联合复旦大学陆路、姜世勃团队开发了一种安全有效的PS仿生纳米颗粒(PS-GAMP),能够促进流感疫苗激活产生抵抗异种亚型流感病毒的广谱性免疫反应,相关研究成果于2月21日发表在《Science》上,题为"Pulmonary surfactant-biomimetic nanoparticles potentiate heterosubtypic influenza immunity"。
研究人员合成了仿生PS的脂质体包载了cGAMP形成了一种新型佐剂,这种佐剂(PS-GAMP)可有效增强流感疫苗诱导模拟无病毒感染的早期阶段的小鼠产生体液免疫反应和CD8+ T细胞的免疫反应,同时不会产生过度炎症。经鼻内注射PS-GAMP佐剂和H1N1疫苗2天后,小鼠可以 对H1N1、H3N2、H5N1和H7N9病毒保持至少6个月的交叉保护,同时还可以保持肺记忆CD8+ T细胞。随后研究人员在雪貂中验证了其佐剂效应。研究人员发现当肺泡上皮细胞(AECs)缺乏sting基因或间隙连接被抑制时,PS-GAMP介导的调节作用被大大消除。总的而言,本研究 发现AECs在诱导异型免疫中起着关键作用,而研究人员开发的PS-cGAMP可以作为一种广谱佐剂对抗多种流感。
5.Science:揭示一种奇怪的海洋动物在一生当中都可产生卵子和精子之谜
doi:10.1126/science.aay6782
一种鲜为人知的海洋生物通常生长在死的寄居蟹的蟹壳上,这听起来似乎不太可能成为科学家们的研究对象,但这种动物有一种罕见的能力,它可以在一生中制造卵子和精子。这种称为贝螅(Hydractinia)的动物之所以能够做到这一点,是因为它会产生生殖细胞---卵子和精子的前体细胞,而且在整个生命过程中都不会停止。研究这种独特的能力可能为人类生殖系统发育和人类生殖相关疾病的形成提供新的见解。
在一项新的研究中,来自美国国家人类基因组研究所、佛罗里达大学和爱尔兰国立高威大学的研究人员报道贝螅成体干细胞中的Tfap2基因激活可以将这些干细胞转化为生殖细胞,并且这一个过程可以不断重复。相关研究结果发表在2020年2月14日的Science期刊上,论文标题为“Transcription factor AP2 controls cnidarian germ cell induction”。
论文共同作者、美国国家人类基因组研究所计算基因组学部主任Andy Baxevanis博士说,“通过测序和研究在实验室中更易于操作的简单生物的基因组,我们能够梳理出有关决定生殖细胞命运的生物学基础的重要见解,这些知识最终可能有助于我们更好地理解人类生殖障碍的潜在过程。”
6.Science:从结构上揭示INSTI药物结合HIV整合体机制
doi:10.1126/science.aay8015
在一项新的研究中,来自美国国家糖尿病与消化疾病研究所、美国国家癌症研究所、沙克生物研究所和斯克里普斯研究所的研究人员发现了一类强大的HIV药物如何结合HIV整合体(intasome)的一个关键部分。通过首次解析出这种整合体与不同药物结合在一起时的三维结构,他们发现了是什么让这类药物如此有效。这项研究提供了可能有助于设计或改进HIV新疗法的重要见解。相关研究结果近期发表在Science期刊上,论文标题为“Structural basis for strand transfer inhibitor binding to HIV intasomes”。

图片来自Salk Institute。
HIV整合体是这种病毒感染的一种关键结构,它由HIV蛋白整合酶(integrase)和病毒DNA链组成,而且是在这种病毒入侵人细胞时形成的。这种整合体进入人细胞,随后进行必要的化学反应,从而将这种病毒的遗传物质整合到人DNA中。一些称为整合酶链转移抑制剂(integrase strand transfer inhibitor, INSTI)的药物成功地阻断这种整合体;当它不能将病毒DNA整合到人类基因组中时,HIV就不能够感染人细胞。目前,有四种INSTI药物获得美国食品药物管理局(FDA)的批准,还有一些正在开发当中。
在这项新的研究中,Lyumkis的研究团队获得了HIV整合体被四种INSTI---市售药物bictegravir;三种称为4f、4d和4c 的实验性化合物---之一阻断时的结构。他们使用了倾斜单粒子低温电子显微镜(single-particle cryo-electron microscopy(他们帮助优化的一种成像技术)来揭示每种HIV整合体-药物复合物的结构。
Lyumkis的第一个观察结果是,这些药物与HIV整合体结合在一起时与它们与PFV整合体结合在一起时有何不同。比如,化合物4f在与PFV整合体结合时会回环到它自身上,而在与HIV整合体结合时却保持相对平坦,这些细节可以帮助人们改善潜在的未来分子的结合特性。
7.Science:HIV耐药性机制新见解
doi:10.1126/science.aay4919
如今,已有许多有助于控制HIV感染的药物,包括整合酶链转移抑制剂在内。该药物家族中有四种药物:raltegravir,elvitegravir,dolutegravir和bictegravir。它们都通过与HIV的一种被称为整合酶的关键酶类结合而起作用,以阻止其将病毒的遗传物质插入人体细胞的DNA中。尽管最初非常有效,但随着时间的流逝,HIV会对这些药物产生抵抗力。
近日,Dana-Farber癌症研究所的研究揭示了HIV对多种药物产生耐药性的机制,这一发现为开发更有效的治疗方法打开了大门。这项研究于2020年1月30日在《Science》杂志上在线发表,该研究发现了HIV产生药物耐药性的机制。尽管这些药物通常在结合和阻断整合酶方面非常有效,但随着时间的流逝,病毒会削弱药物的能力,从而使HIV再次起作用。
“我们的结构生物学方面的研究使得我们能够看到药物与病毒酶活性位点的精确结构。这一结构将为设计更有效的整合酶抑制剂提供参考,从而可以改善数百万HIV感染者的生活。”美国Dana-Farber癌症研究所癌症免疫学和病毒学教授Alan Engelman说。
8.Science:浙大科学家揭示小胶质细胞在记忆调节中起着关键作用
doi:10.1126/science.aaz2288
小胶质细胞是大脑中的常驻免疫细胞,它们是第一反应者,总是在寻找发生差错的地方。它们大约占我们脑细胞的10%。在过去,它们被认为是大脑中的被动旁观者,仅在受伤或感染时,它们才起作用。这些细胞最早是由德国医生Rudolf Virchow于1856年观察到的,后来被称为小胶质细胞,意为“小胶水”。
如今,在一项新的以小鼠为实验对象的研究中,来自中国浙江大学医学院的研究人员发现小胶质细胞实际上可能是记忆保持的关键因素。如果在人类中发现同样的效果,那么这可能导致人们开发出更好地治疗健忘症、阿尔茨海默病和其他影响记忆力的疾病的方法。相关研究结果发表在2020年2月7日的Science期刊上,论文标题为“Microglia mediate forgetting via complement-dependent synaptic elimination”。
这项新研究表明小胶质细胞与小鼠的记忆保持密切相关。小鼠经历了恐惧条件反射fear conditioning)任务,使得当将它们放置在它们记得经历过一些负面事情—在这项研究中,指的是对它们的脚施加较小的电击---的环境中时,它们会因恐惧而呆立不动。
在35天的时间内,小鼠的僵直反应(freezing response)从70%降低到20%,这表明它们已经忘记了这种特定环境的负面影响。然后,这些作者使用了一系列科学工具,包括遗传、药理和生化方法,移除这些小鼠大脑中的小胶质细胞,并再次进行了实验。
实验结果表明,移除小胶质细胞改变了它们对这个任务的反应。大约50%的小鼠(在上述实验中,这一比例为20%)即使在类似的一段时间后仍记得这种负面经历。基于此,提出的一种假设是小胶质细胞是巩固这些记忆以及支持哪些记忆被遗忘和哪些记忆被保持的关键。这项研究继续发现,正是这些小鼠内部的突触重新排列才导致了这一观察结果。
9.Science:颠覆常规!揭示蚊子找到人类来叮咬的新机制
doi:10.1126/science.aay9847; doi:10.1126/science.aba4484
在一项新的研究中,美国布兰戴斯大学生物学教授Paul Garrity、博士生Chloe Greppi、博士后研究员Willem Laursen和其他几位同事报道,他们发现了蚊子如何利用人类体温来寻找和叮咬 人类的一个重要方面。相关研究结果发表在2020年2月7日的Science期刊上,论文标题为“Mosquito heat seeking is driven by an ancestral cooling receptor”。

图片来自CC0 Public Domain。
在实验中,这些研究人员敲除了负责产生IR21a受体的蚊子基因。然后,他们将大约60只突变蚊子(即基因敲除蚊子)放入一个鞋盒大小的容器中,在这个容器的后壁上装有一块板,将这块板 加热到接近37℃的核心体温,然后向这些蚊子喷入一小撮二氧化碳,以模仿人类的呼吸。当非突变蚊子快速地聚集在这块接近37℃的板上试图觅食时,突变蚊子很大程度上忽略了这块板。在 没有IR21a受体的情形下,它们将无法再将自己引向附近最热的地方。
在第二个实验中,将这些蚊子放在一个小网眼笼子中。这些研究人员在这个笼子上方放置了两个充满人类血液的小瓶,其中一个加热到22.78℃(室温),另一个加热到31.1℃(人手的表面温 度)。相比于处于相同环境下的非突变蚊子,突变蚊子对31.1℃血液的偏好降低了。
根据Garrity的说法,每当蚊子向较低温度移动时,IR21a受体就会被激活。由于人类通常比周围环境温暖,这意味着在蚊子接近人类时,IR21a保持沉默。但是,如果蚊子偏离路线并开始远离 它的温血猎物,那么IR21a会被激活,只有在蚊子改道后它才会关闭。
10.Science:细胞间通讯如何导致白血病发生?
doi:10.1126/science.aaw3242
近日,发表在《Science》杂志上的一项新的研究揭示了血液干细胞中的“流氓“通讯如何导致白血病的发生。这一发现为开发阻止该过程的新靶向治疗铺平道路。
当干细胞突变导致它们产生过多的血细胞时,就会发生诸如白血病之类的血液癌症。对此,来自约克大学的研究人员揭示了这些突变如何使细胞偏离其正常的相互通讯轨道,从而促使血细胞 的发育失控。
在这一研究中,科学家使用超分辨率荧光显微镜来研究血液干细胞彼此之间实时对话的方式。他们观察了细胞是如何从“信号蛋白”接收指令。该信号蛋白会与另一细胞表面的受体结合,然 后传递信号告知细胞如何响应。进一步,研究人员发现与某些类型血液癌症相关的突变会导致血液干细胞变得“无赖”,即在没有细胞因子的情况下仍能够进行交流。
约克大学生物医学研究所和约克大学生物系的伊恩·希区柯克教授说:“我们的身体每天通过相互之间的信号传递产生数十亿个血细胞。细胞因子的作用就像工厂的监督员一样,调节这一过 程并控制不同血细胞类型的发育和增殖。我们的研究揭示了一个以前未知的机制,即细胞发生突变后如何导致其在不受细胞因子的调控下发生信号传导,从而导致白血病等血液癌症的发生。 了解这种机制有助于新药的开发。”
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


