3个月注射一次!诺华新一代眼科药物Beovu获欧盟批准,治疗湿性年龄相关性黄斑变性(wet-AMD)!
来源:本站原创 2020-02-18 14:54
2020年02月18日讯 /生物谷BIOON/ --诺华(Novartis)近日宣布,欧盟委员会(EC)已批准新一代眼科药物Beovu(brolucizumab,又名RTH258),用于治疗湿性年龄相关性黄斑变性(wet-AMD,又名新生血管性AMD,nAMD)。此次批准适用于所有27个欧盟成员国以及英国、冰岛、挪威和列支敦士登。在欧盟,估计有170万人受湿

2020年02月18日讯 /生物谷BIOON/ --诺华(Novartis)近日宣布,欧盟委员会(EC)已批准新一代眼科药物Beovu(brolucizumab,又名RTH258),用于治疗湿性年龄相关性黄斑变性(wet-AMD,又名新生血管性AMD,nAMD)。此次批准适用于所有27个欧盟成员国以及英国、冰岛、挪威和列支敦士登。在欧盟,估计有170万人受湿性AMD影响,该病是65岁以上人群严重视力丧失和失明的主要原因。
Beovu是一种新一代抗血管内皮生长因子(VEGF)药物,在美国于2019年10月获批治疗湿性AMD。值得一提的是,诺华使用了一张优先审评券(PRV)来加速Beovu的美国监管审查,将其审查周期由常规的10个月缩短至了6个月。2020年1月,Beovu还获得了瑞士医疗和澳大利亚的批准。诺华致力于将Beovu带给全球的患者,目前Beovu也正在接受加拿大、日本和巴西监管机构的审查。
湿性AMD是导致失明的主要原因,影响着全球2000多万人,频繁的注射是湿性AMD患者放弃治疗的常见原因。在美国和欧盟,Beovu是获得监管批准的首个与再生元重磅眼科产品Eylea(aflibercept,阿柏西普)相比能更大程度地减少视网膜液、同时在符合资格的wet-AMD患者中在3个月加载期(loading phase)之后以每3个月一次给药间隔治疗不影响疗效的抗VEGF药物,可通过减少频繁注射提高患者的治疗依从性,从而有效维持患者视力。
现有的眼科治疗产品标签表明,每12周(3个月)一次给药方案疗效欠佳。Beovu是首个在治疗的第一年能提供较少的给药频率同时维持治疗有效性的药物,这将使湿性AMD患者有更多的时间去关注其生活中重要的事情。
诺华制药总裁Marie France Tschudin表示:“湿性AMD患者往往是老年人,可能在管理疾病方面面临着重大的挑战。我们相信,Beovu及其减少视网膜液的能力将带来巨大的治疗价值,帮助医生根据疾病活动优化对患者的治疗。通过这种创新生物制剂的批准,诺华正在继续为湿性AMD患者重新构想治疗方案。”
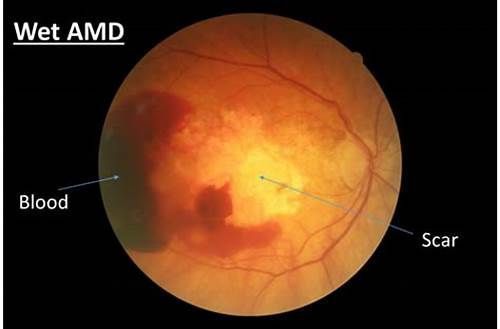
湿性AMD(wet-AMD,图片来源retinaboston.com)
此次批准基于III期HAWK研究(NCT02307682)和HARRIER研究(NCT02434328)的数据。这2项研究是在wet-AMD患者中前瞻性地证实Beovu以每12周一次(3个月一次)给药方案启动治疗表现出显著疗效的首批也是唯一一批全球性头对头临床研究。2项研究均为前瞻性、随机、双盲、多中心研究,在wet-AMD患者中开展,评估了Beovu相对于Eylea的疗效和安全性。2项研究中,符合资格的患者可以在加载期后立即给予3个月给药间隔的维持治疗。
结果显示,2项研究均达到了主要终点,在治疗第一年(第48周),Beovu(6mg)在改善视力方面疗效非劣效于Eylea,具体数据为:HAWK研究和HARRIER研究中,Beovu(6mg)治疗组最佳矫正视力(BCVA)相对基线的平均变化分别为6.6个字母(Eylea治疗组为6.8个字母)和6.9个字母(Eylea治疗组为7.6个字母)。2项研究中,Beovu治疗组大约30%的患者在治疗一年时BCVA提高至少15个字母。
此外,Beovu(6mg)在疾病进展关键指标的3个次要终点方面也表现出优势:疾病活动度、中央视野视网膜厚度、视网膜液(视网膜内液和/或视网膜下液)。具体数据为:(1)在治疗第16周和第1年时,与Eylea治疗组相比,Beovu(6mg)治疗组有疾病活动的患者比例更低(第16周[HAWK研究:24.0% vs 34.5%,p=0.001;HARRIER研究:22.7% vs 32.2%,p=0.002];第1年时[HAWK研究:23.5% vs 33.5%,p=0.002;HARRIER研究:21.9% vs 31.4%,p=0.002]);(2)在治疗第16周和第1年,与Eylea治疗组相比,Beovu(6mg)治疗组有视网膜内液(IRF)和/或视网膜下液(SRF)的患者比例显著减少(第16周:HAWK研究和HARRIER研究中均减少35%;第1年时:HAWK研究中减少30%,HARRIER研究中减少41%)。(3)治疗第1年时,与Eylea治疗组相比,Beovu治疗组中央视野视网膜厚度相对基线也显著减少(HAWK研究:LS 平均 -172.8 μm vs. -143.7 μm,p=0.001;HARRIER研究:LS平均 -193.8μm vs -143.9μm,p<0.001)。解剖学视网膜液结果显示,Beovu优于Eylea。
此外,在第一年,Beovu(6mg)治疗组有超过一半的患者维持3个月给药间隔(HAWK研究56%,HARRIER研究51%)。在第一年,Beovu(6mg)治疗组在加载期后药开始3个月给药方案的患者,有85%(HAWK研究)和82%(HARRIER)的概率保持这一治疗时间间隔。研究中,Beovu安全性与Eylea总体相当。
Beovu的活性药物成分为brolucizumab(RTH258),这是一种人源化单链抗体片段(scfv),靶向所有类型的血管内皮生长因子-A(VEGF-A)。单链抗体片段因其体积小、组织渗透性增强、系统循环的快速清除、药物递送特性而在药物开发中受到高度关注。
brolucizumab的创新结构使其仅有26kDa大小,针对VEGF-A所有亚型均有很强的抑制作用,并具有很高的亲和力。在临床前研究中,brolucizumab通过阻断配体-受体相互作用来抑制VEGF受体的激活。增加的VEGF途径信号与病理性眼部血管生成和视网膜水肿有关。在脉络膜视网膜血管疾病患者中,抑制VEGF途径可抑制新生血管病变的生长,缓解视网膜水肿,改善视力。(生物谷Bioon.com)
原文出处:Novartis receives EC approval for Beovu®, a next-generation anti-VEGF treatment for wet AMD, a leading cause of blindness worldwide
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


