2020年1月Cell期刊不得不看的亮点研究
来源:本站原创 2020-01-31 23:59
2020年1月31日讯/生物谷BIOON/---2020年1月份即将结束了,1月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2020年1月31日讯/生物谷BIOON/---2020年1月份即将结束了,1月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:新研究发现102个与自闭症相关的基因
doi:10.1016/j.cell.2019.12.036
在一项迄今为止针对自闭症谱系障碍(ASD)的最大规模遗传学研究中,来自全球50多个中心的研究人员报道102个基因与这种疾病有关,包括几十个之前未被发现的基因。某些基因还与智力障碍和发育迟缓有关。但是其他的一些基因是这种疾病特有的,并且似乎与作为这种疾病的典型特征的社交困难有关。了解这些与这种疾病相关的基因将有助于人们更好地理解它的病因并且可能为患有严重ASD的儿童开发出新的药物疗法。相关研究结果于2020年1月23日在线发表在Cell期刊上,论文标题为“Large-Scale Exome Sequencing Study Implicates Both Developmental and Functional Changes in the Neurobiology of Autism”。论文通讯作者为Stephan J. Sanders、Kathryn Roeder、Mark J. Daly和Joseph D. Buxbaum。

还需要开展更多的研究来准确了解所有这些基因的作用。但是,这些研究人员发现,大多数风险基因在大脑发育的早期就较为活跃,并在调节其他基因的活性或脑细胞之间的交流中发挥作用。 这些风险基因在“兴奋性”和“抑制性”神经元中也有活性。这表明自闭症不仅与一种主要类型的脑细胞有关,而且还涉及脑细胞功能受到“许多破坏”。
2.Cell:挑战常规!髓鞘并不绝缘,它形成大脑中传播电信号的高速公路
doi:10.1016/j.cell.2019.11.039
在一项新的研究中,来自荷兰神经科学研究所和德国马克斯普朗克实验医学研究所的研究人员使用一种新技术来展示电脉冲如何在大脑中高速传播。它似乎表明包围着神经元的髓鞘形成一种产生多种电势波的同轴电缆,这些电势波的传播方式比之前预想的要复杂得多。这些发现使得我们能够提出更好的理论和工具来理解脱髓鞘疾病,包括最常见的神经系统疾病,即多发性硬化症。相关研究结果发表在2020年1月23日的Cell期刊上,论文标题为“Saltatory Conduction along Myelinated Axons Involves a Periaxonal Nanocircuit”。
这些研究人员使用电子显微镜测量了神经细胞膜与这种绝缘的髓鞘之间的距离,结果证明这种距离为12纳米,大约比一根头发薄1万倍。此外,这些研究人员使用一种新技术来使得电信号可见,并利用超级计算机来计算髓鞘的具体特性。Kole解释说,“所有的这些发现共同表明髓鞘并不是绝缘的,而是像同轴电缆一样形成了一个额外的层,从而产生多种以比以前想象的更复杂的方式传播的电势波。”
3.Cell:新研究揭示蛋白BFD1是弓形虫分化的主调节物
doi:10.1016/j.cell.2019.12.013
在一项新的研究中,来自美国怀特黑德生物医学研究所和麻省理工学院的研究人员通过Cas9介导的筛选和单细胞分析,鉴定出在细胞培养物和小鼠中的这种分化所必需的Myb样转录因子(BFD1)。相关研究结果发表在2020年1月23日的Cell期刊上,论文标题为“Identification of a Master Regulator of Differentiation in Toxoplasma”。
在遭受应激时,BFD1在弓形虫中积累,它的合成表达足以促进速殖子分化为缓殖子。BFD1是弓形虫慢性期分化的主调控物。缺乏BFD1的弓形虫无法在细胞培养物中诱导分化,也不能在小鼠中形成细胞内囊。此外,BFD1的条件性表达足以诱导分化。
由此可见,BFD1提供一种研究和控制弓形虫分化的基因开关,这将有助于人们开发出阻止和治疗弓形虫慢性感染的方法。
4.Cell:揭示精细胞存在广泛的转录扫描机制
doi:10.1016/j.cell.2019.12.015
在一项新的研究中,来自美国纽约大学等研究机构的研究人员发现精细胞(即精子)在成熟过程中开启它们的大多数基因,而不是像通常那样遵循它们的遗传指令,而是在将DNA传递给下一代之前对它进行修复。相关研究结果发表在2020年1月23日的Cell期刊上,论文标题为“Widespread Transcriptional Scanning in the Testis Modulates Gene Evolution Rates”。
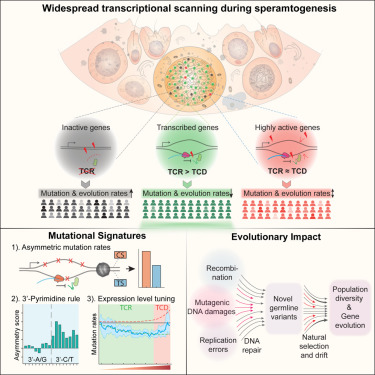
这项研究着重关注生物学的一个奥秘:人精细胞激活的基因数量是迄今为止最多的(90%),这种模式也在小鼠、鸟类和果蝇等其他物种中观察到。大多数器官中的细胞表达大约60%的遗传密码,或仅表达某种细胞类型完成它的特定任务所需的一部分基因。
令人吃惊的是,这些研究人员发现,即使在精细胞发育过程中被激活几次的基因包含的DNA密码错误也要比未表达的基因少15%至20%,而这种差异归因于转录偶联修复(transcription-coupled repair, TCR)。在转录期间,这个过程将在有缺陷的DNA片段包含的指令被转换为RNA之前将其替换掉。RNA转录本随后经表达后产生构成细胞结构和信号的蛋白。
5.Cell:首次利用蛇干细胞培育出分泌毒液的蛇毒腺类器官
doi:10.1016/j.cell.2019.11.038
在一项新的研究中,来自荷兰胡布勒支研究所等研究机构的研究人员利用蛇干细胞培养出可分泌功能性毒素的蛇毒腺的微型化组织。相关研究结果发表在2020年1月23日的Cell期刊上,论文标题为“Snake stem cells used to create venom-producing organoids”。
科学家们此前利用小鼠和人类干细胞培养出这类称为类器官(organoid)的微型化组织,包括模拟神经网络的“微型大脑(minibrain)”,但是这项研究是首次表明这种相同的技术也可用于蛇组织。
论文通讯作者、胡布勒支研究所的Hans Clevers博士及其研究团队使用人类生长因子来培养蛇毒腺类器官,但是它与哺乳动物类器官之间存在一个关键的区别:温度。Clevers表示,鉴于爬行动物是冷血的,因此保存蛇类器官的温度需要比人类和小鼠类器官低几度。
这项实验始于Clevers实验室的三名研究生,他们想知道他们是否可以培育其他物种的类器官。他们从饲养员那里收到了珊瑚眼镜蛇(Aspidelaps lubricus)的卵,并使用了实验室培育哺乳动物类器官的方法来产生蛇毒腺类器官,这种蛇毒腺类器官产生的毒素与真蛇产生的相同。Clevers实验室继续培育其他八个物种的类器官。
6.Cell:揭示肠道肌层巨噬细胞限制肠道感染诱导的神经元死亡机制
doi:10.1016/j.cell.2019.12.002
有时,肠道感染的结束仅仅是更多痛苦的开始。比如,在那些患有旅行性腹泻(traveler's diarrhea)的人中,少数不幸的人会患上一种称为肠易激综合征(IBS)的肠道慢性炎症。
科学家们不确定这种疾病如何发生,但是有些人认为肠道感染可能会通过损害肠道神经系统来导致肠易激综合征。在一项新的研究中,来自美国洛克菲勒大学的研究人员仔细研究了肠道中的神经元如何死亡以及免疫系统通常如何保护它们。这项研究以小鼠为研究对象,提供了关于肠易激综合征的新见解,并且可能有助于人们开发出潜在新的治疗方法。相关研究结果近期发表在Cell期刊上,论文标题为“Adrenergic Signaling in Muscularis Macrophages Limits Infection-Induced Neuronal Loss”。
7.Cell:神经系统或在抵御肠道感染过程中扮演着关键角色
doi:10.1016/j.cell.2019.12.016
友好的肠道菌群与免疫系统之间和平微妙的共存依赖于免疫细胞和肠道内壁细胞之间高度协调信息的交换,近日,一项刊登在国际杂志Cell上的研究报告中,来自耶鲁大学的科学家们通过研究发现,两种特殊的细胞类型或对于抵御机体危险感染的抗菌化合物的产生非常重要。
研究者Richard Flavell教授说道,我们认为,免疫系统的细胞和肠道屏障细胞能相互协调,通过动员抗菌蛋白的产生来抵御机体外来的入侵者,然而这个故事其实并不是真的,机体神经系统会告诉屏障细胞该做什么。事实证明,在抗击肠道病原体的斗争中,“步兵”就是免疫系统中的白细胞介素-18分子(IL-18),而白细胞介素证实机体免疫系统的一部分。
当研究人员从免疫细胞和肠道屏障细胞中剔除IL-18后他们发现,小鼠能够有效抵御沙门氏菌引起的肠道感染,研究者指出,这或许就排除了诱发机体免疫反应的因素,但不携带神经系统细胞所产生的IL-18的小鼠则更容易受到感染,这就揭示了其在抵御感染过程中发挥的关键角色。
8.Cell:新研究表明新一代免疫检查点抑制剂呼之欲出
doi:10.1016/j.cell.2018.10.014
在一项新的研究中,来自法国国家科学研究中心等研究机构的研究人员发现作为一种新型的免疫检查点抑制剂,NKG2A抗体能够潜在地促进T细胞和自然杀伤细胞(NK细胞)的抗肿瘤能力,当与现有的癌症免疫疗法相结合时可更好地治疗癌症患者。相关研究结果近期发表在Cell期刊上,论文标题为“Anti-NKG2A mAb Is a Checkpoint Inhibitor that Promotes Anti-tumor Immunity by Unleashing Both T and NK Cells”。
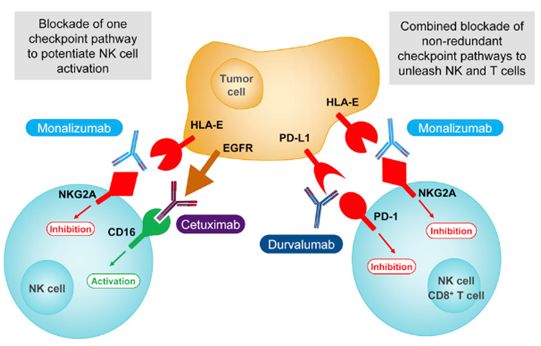
这项研究的关键在于一种称为NKG2A的受体分子。这些研究人员发现阻断这种受体可增强小鼠体内的NK细胞和T细胞的免疫活性,从而提高抗肿瘤免疫反应。他们开发出一种称为Monalizumab的NKG2A抗体。它是一种人源化的单克隆抗体。
在实验中,这些研究人员将小鼠分为四组,第一组小鼠仅给予Monalizumab单抗,第二组小鼠仅给予PD-L1单抗,第三组小鼠联合给予Monalizumab单抗和PD-L1单抗,第四组小鼠作为对照组。这些小鼠事先通过皮下注射接种了B细胞淋巴瘤细胞。
他们发现相比于对照组,仅给予PD-L1单抗最多可让40%的小鼠存活下来,单独给予Monalizumab单抗并没有带来显著的抗癌作用,但是联合给予这两种单抗最多可让75%的小鼠存活下来,这就揭示了NKG2A单抗联合用药具有强大的抗癌潜力。
更重要的是,这些研究人员还在31例鳞状细胞头颈癌患者中开展II期临床试验。这些患者可分为多组,分别给予不同剂量的Monalizumab单抗。除此之外,这些患者还接受西妥昔单抗(cetuximab)治疗。西妥昔单抗是一种EGFR抑制剂,已被批准用于治疗头颈癌。中期临床试验结果Monalizumab单抗和西妥昔单抗的联合用药达到了31%的客观缓解率,有50%患者的病情得到稳定控制,更有1名患者的病灶完全消失。
9.Cell:新型工具有望加速抗体识别和疫苗开发研究 或能使HIV等多种疾病获益
doi:10.1016/j.cell.2019.11.003
近日,一项刊登在国际杂志Cell上的研究报告中,来自范德堡大学的科学家们通过研究开发了一种新工具或有望加速抗体疫苗的研究;这种名为“LIBRA-seq”的工具或有望让抗体发现和疫苗开发研究领域迅速扩大。
目前,由于技术限制,研究人员可能会花费一年时间从B细胞所产生的数以亿计的抗体中识别出一种单一的抗体,随后将其开发成为一种药物来识别并攻击特殊病原体上的抗原标志物;因此,研究者Ian Setliff及其同事就想知道是否能够以一种高通量的方式对抗体序列和抗原特异性同时进行绘图。
研究者Georgiev表示,这听起来似乎是一个疯狂的想法,而且很有可能是行不通的,但如今研究者实现了,他们在短短几周时间内疚能够发现一种抵御HIV的新型抗体。LIBRA-seq工具的开发和确认或能通过测序的方法将B细胞受体抗原特异性联系起来。研究者表示,通常情况下我们很难知道抗体序列,而且也并不知道针对抗体的抗原特异性是什么。
10.Cell:关键蛋白参与神经元的迁移以及突触的形成
doi:10.1016/j.cell.2019.12.014
此前研究表明,Teneurin,Latrophilin和FLRT这三种蛋白质结合在一起,有助于神经元之间保持紧密接触,促进突触形成并在细胞之间交换信息。然而,在大脑发育的早期,上述蛋白质的相互作用则会导致迁移的神经细胞受到排斥。Teneurin也是一种进化上非常古老的蛋白质,在细菌,蠕虫,果蝇和脊椎动物等各种生物中都发现了相关蛋白质的表达。然而,当神经元尚未形成突触时,这些蛋白质在大脑发育过程中的作用仍然未知。
针对上述问题,来自德国的研究人员详细研究了Teneurin-Latrophilin蛋白复合物的结构。使用高分辨率X射线晶体学,他们找到了有关其在早期大脑发育中的功能的更多信息。
结构分析和随后的FLRT结合模拟分析使研究人员能够识别三种蛋白质相互连接的结合位点。进一步,研究者们通过破坏这些结合位点,发现小鼠大脑中胚胎神经元的迁移行为发生了变化。 胚胎神经元通常只有一个胞体和较短的突起,称为神经突。当其中的Teneurin和FLRT与Latrophilin结合时,细胞就会发生互相排斥。这一机制导致迁移的细胞部分失去其迁移速率。但是,当在轴突表面时,Teureurin与Latrophilin相遇时不再触发排斥反应。此时此刻,蛋白质将细胞拉在一起,诱导突触的形成,并最终导致交流神经元网络的组装。 “相同的蛋白质互作导致完全不同的反应,这根本上取决于它们在细胞上的位置。”(生物谷 Bioon.com)
1.Cell:新研究发现102个与自闭症相关的基因
doi:10.1016/j.cell.2019.12.036
在一项迄今为止针对自闭症谱系障碍(ASD)的最大规模遗传学研究中,来自全球50多个中心的研究人员报道102个基因与这种疾病有关,包括几十个之前未被发现的基因。某些基因还与智力障碍和发育迟缓有关。但是其他的一些基因是这种疾病特有的,并且似乎与作为这种疾病的典型特征的社交困难有关。了解这些与这种疾病相关的基因将有助于人们更好地理解它的病因并且可能为患有严重ASD的儿童开发出新的药物疗法。相关研究结果于2020年1月23日在线发表在Cell期刊上,论文标题为“Large-Scale Exome Sequencing Study Implicates Both Developmental and Functional Changes in the Neurobiology of Autism”。论文通讯作者为Stephan J. Sanders、Kathryn Roeder、Mark J. Daly和Joseph D. Buxbaum。

图片来自Cell, 2020, doi:10.1016/j.cell.2019.12.036。
还需要开展更多的研究来准确了解所有这些基因的作用。但是,这些研究人员发现,大多数风险基因在大脑发育的早期就较为活跃,并在调节其他基因的活性或脑细胞之间的交流中发挥作用。 这些风险基因在“兴奋性”和“抑制性”神经元中也有活性。这表明自闭症不仅与一种主要类型的脑细胞有关,而且还涉及脑细胞功能受到“许多破坏”。
2.Cell:挑战常规!髓鞘并不绝缘,它形成大脑中传播电信号的高速公路
doi:10.1016/j.cell.2019.11.039
在一项新的研究中,来自荷兰神经科学研究所和德国马克斯普朗克实验医学研究所的研究人员使用一种新技术来展示电脉冲如何在大脑中高速传播。它似乎表明包围着神经元的髓鞘形成一种产生多种电势波的同轴电缆,这些电势波的传播方式比之前预想的要复杂得多。这些发现使得我们能够提出更好的理论和工具来理解脱髓鞘疾病,包括最常见的神经系统疾病,即多发性硬化症。相关研究结果发表在2020年1月23日的Cell期刊上,论文标题为“Saltatory Conduction along Myelinated Axons Involves a Periaxonal Nanocircuit”。
这些研究人员使用电子显微镜测量了神经细胞膜与这种绝缘的髓鞘之间的距离,结果证明这种距离为12纳米,大约比一根头发薄1万倍。此外,这些研究人员使用一种新技术来使得电信号可见,并利用超级计算机来计算髓鞘的具体特性。Kole解释说,“所有的这些发现共同表明髓鞘并不是绝缘的,而是像同轴电缆一样形成了一个额外的层,从而产生多种以比以前想象的更复杂的方式传播的电势波。”
3.Cell:新研究揭示蛋白BFD1是弓形虫分化的主调节物
doi:10.1016/j.cell.2019.12.013
在一项新的研究中,来自美国怀特黑德生物医学研究所和麻省理工学院的研究人员通过Cas9介导的筛选和单细胞分析,鉴定出在细胞培养物和小鼠中的这种分化所必需的Myb样转录因子(BFD1)。相关研究结果发表在2020年1月23日的Cell期刊上,论文标题为“Identification of a Master Regulator of Differentiation in Toxoplasma”。
在遭受应激时,BFD1在弓形虫中积累,它的合成表达足以促进速殖子分化为缓殖子。BFD1是弓形虫慢性期分化的主调控物。缺乏BFD1的弓形虫无法在细胞培养物中诱导分化,也不能在小鼠中形成细胞内囊。此外,BFD1的条件性表达足以诱导分化。
由此可见,BFD1提供一种研究和控制弓形虫分化的基因开关,这将有助于人们开发出阻止和治疗弓形虫慢性感染的方法。
4.Cell:揭示精细胞存在广泛的转录扫描机制
doi:10.1016/j.cell.2019.12.015
在一项新的研究中,来自美国纽约大学等研究机构的研究人员发现精细胞(即精子)在成熟过程中开启它们的大多数基因,而不是像通常那样遵循它们的遗传指令,而是在将DNA传递给下一代之前对它进行修复。相关研究结果发表在2020年1月23日的Cell期刊上,论文标题为“Widespread Transcriptional Scanning in the Testis Modulates Gene Evolution Rates”。

图片来自Cell, 2020, doi:10.1016/j.cell.2019.12.015。
这项研究着重关注生物学的一个奥秘:人精细胞激活的基因数量是迄今为止最多的(90%),这种模式也在小鼠、鸟类和果蝇等其他物种中观察到。大多数器官中的细胞表达大约60%的遗传密码,或仅表达某种细胞类型完成它的特定任务所需的一部分基因。
令人吃惊的是,这些研究人员发现,即使在精细胞发育过程中被激活几次的基因包含的DNA密码错误也要比未表达的基因少15%至20%,而这种差异归因于转录偶联修复(transcription-coupled repair, TCR)。在转录期间,这个过程将在有缺陷的DNA片段包含的指令被转换为RNA之前将其替换掉。RNA转录本随后经表达后产生构成细胞结构和信号的蛋白。
5.Cell:首次利用蛇干细胞培育出分泌毒液的蛇毒腺类器官
doi:10.1016/j.cell.2019.11.038
在一项新的研究中,来自荷兰胡布勒支研究所等研究机构的研究人员利用蛇干细胞培养出可分泌功能性毒素的蛇毒腺的微型化组织。相关研究结果发表在2020年1月23日的Cell期刊上,论文标题为“Snake stem cells used to create venom-producing organoids”。
科学家们此前利用小鼠和人类干细胞培养出这类称为类器官(organoid)的微型化组织,包括模拟神经网络的“微型大脑(minibrain)”,但是这项研究是首次表明这种相同的技术也可用于蛇组织。
论文通讯作者、胡布勒支研究所的Hans Clevers博士及其研究团队使用人类生长因子来培养蛇毒腺类器官,但是它与哺乳动物类器官之间存在一个关键的区别:温度。Clevers表示,鉴于爬行动物是冷血的,因此保存蛇类器官的温度需要比人类和小鼠类器官低几度。
这项实验始于Clevers实验室的三名研究生,他们想知道他们是否可以培育其他物种的类器官。他们从饲养员那里收到了珊瑚眼镜蛇(Aspidelaps lubricus)的卵,并使用了实验室培育哺乳动物类器官的方法来产生蛇毒腺类器官,这种蛇毒腺类器官产生的毒素与真蛇产生的相同。Clevers实验室继续培育其他八个物种的类器官。
6.Cell:揭示肠道肌层巨噬细胞限制肠道感染诱导的神经元死亡机制
doi:10.1016/j.cell.2019.12.002
有时,肠道感染的结束仅仅是更多痛苦的开始。比如,在那些患有旅行性腹泻(traveler's diarrhea)的人中,少数不幸的人会患上一种称为肠易激综合征(IBS)的肠道慢性炎症。
科学家们不确定这种疾病如何发生,但是有些人认为肠道感染可能会通过损害肠道神经系统来导致肠易激综合征。在一项新的研究中,来自美国洛克菲勒大学的研究人员仔细研究了肠道中的神经元如何死亡以及免疫系统通常如何保护它们。这项研究以小鼠为研究对象,提供了关于肠易激综合征的新见解,并且可能有助于人们开发出潜在新的治疗方法。相关研究结果近期发表在Cell期刊上,论文标题为“Adrenergic Signaling in Muscularis Macrophages Limits Infection-Induced Neuronal Loss”。
7.Cell:神经系统或在抵御肠道感染过程中扮演着关键角色
doi:10.1016/j.cell.2019.12.016
友好的肠道菌群与免疫系统之间和平微妙的共存依赖于免疫细胞和肠道内壁细胞之间高度协调信息的交换,近日,一项刊登在国际杂志Cell上的研究报告中,来自耶鲁大学的科学家们通过研究发现,两种特殊的细胞类型或对于抵御机体危险感染的抗菌化合物的产生非常重要。
研究者Richard Flavell教授说道,我们认为,免疫系统的细胞和肠道屏障细胞能相互协调,通过动员抗菌蛋白的产生来抵御机体外来的入侵者,然而这个故事其实并不是真的,机体神经系统会告诉屏障细胞该做什么。事实证明,在抗击肠道病原体的斗争中,“步兵”就是免疫系统中的白细胞介素-18分子(IL-18),而白细胞介素证实机体免疫系统的一部分。
当研究人员从免疫细胞和肠道屏障细胞中剔除IL-18后他们发现,小鼠能够有效抵御沙门氏菌引起的肠道感染,研究者指出,这或许就排除了诱发机体免疫反应的因素,但不携带神经系统细胞所产生的IL-18的小鼠则更容易受到感染,这就揭示了其在抵御感染过程中发挥的关键角色。
8.Cell:新研究表明新一代免疫检查点抑制剂呼之欲出
doi:10.1016/j.cell.2018.10.014
在一项新的研究中,来自法国国家科学研究中心等研究机构的研究人员发现作为一种新型的免疫检查点抑制剂,NKG2A抗体能够潜在地促进T细胞和自然杀伤细胞(NK细胞)的抗肿瘤能力,当与现有的癌症免疫疗法相结合时可更好地治疗癌症患者。相关研究结果近期发表在Cell期刊上,论文标题为“Anti-NKG2A mAb Is a Checkpoint Inhibitor that Promotes Anti-tumor Immunity by Unleashing Both T and NK Cells”。

图片来自Cell, doi:10.1016/j.cell.2018.10.014。
这项研究的关键在于一种称为NKG2A的受体分子。这些研究人员发现阻断这种受体可增强小鼠体内的NK细胞和T细胞的免疫活性,从而提高抗肿瘤免疫反应。他们开发出一种称为Monalizumab的NKG2A抗体。它是一种人源化的单克隆抗体。
在实验中,这些研究人员将小鼠分为四组,第一组小鼠仅给予Monalizumab单抗,第二组小鼠仅给予PD-L1单抗,第三组小鼠联合给予Monalizumab单抗和PD-L1单抗,第四组小鼠作为对照组。这些小鼠事先通过皮下注射接种了B细胞淋巴瘤细胞。
他们发现相比于对照组,仅给予PD-L1单抗最多可让40%的小鼠存活下来,单独给予Monalizumab单抗并没有带来显著的抗癌作用,但是联合给予这两种单抗最多可让75%的小鼠存活下来,这就揭示了NKG2A单抗联合用药具有强大的抗癌潜力。
更重要的是,这些研究人员还在31例鳞状细胞头颈癌患者中开展II期临床试验。这些患者可分为多组,分别给予不同剂量的Monalizumab单抗。除此之外,这些患者还接受西妥昔单抗(cetuximab)治疗。西妥昔单抗是一种EGFR抑制剂,已被批准用于治疗头颈癌。中期临床试验结果Monalizumab单抗和西妥昔单抗的联合用药达到了31%的客观缓解率,有50%患者的病情得到稳定控制,更有1名患者的病灶完全消失。
9.Cell:新型工具有望加速抗体识别和疫苗开发研究 或能使HIV等多种疾病获益
doi:10.1016/j.cell.2019.11.003
近日,一项刊登在国际杂志Cell上的研究报告中,来自范德堡大学的科学家们通过研究开发了一种新工具或有望加速抗体疫苗的研究;这种名为“LIBRA-seq”的工具或有望让抗体发现和疫苗开发研究领域迅速扩大。
目前,由于技术限制,研究人员可能会花费一年时间从B细胞所产生的数以亿计的抗体中识别出一种单一的抗体,随后将其开发成为一种药物来识别并攻击特殊病原体上的抗原标志物;因此,研究者Ian Setliff及其同事就想知道是否能够以一种高通量的方式对抗体序列和抗原特异性同时进行绘图。
研究者Georgiev表示,这听起来似乎是一个疯狂的想法,而且很有可能是行不通的,但如今研究者实现了,他们在短短几周时间内疚能够发现一种抵御HIV的新型抗体。LIBRA-seq工具的开发和确认或能通过测序的方法将B细胞受体抗原特异性联系起来。研究者表示,通常情况下我们很难知道抗体序列,而且也并不知道针对抗体的抗原特异性是什么。
10.Cell:关键蛋白参与神经元的迁移以及突触的形成
doi:10.1016/j.cell.2019.12.014
此前研究表明,Teneurin,Latrophilin和FLRT这三种蛋白质结合在一起,有助于神经元之间保持紧密接触,促进突触形成并在细胞之间交换信息。然而,在大脑发育的早期,上述蛋白质的相互作用则会导致迁移的神经细胞受到排斥。Teneurin也是一种进化上非常古老的蛋白质,在细菌,蠕虫,果蝇和脊椎动物等各种生物中都发现了相关蛋白质的表达。然而,当神经元尚未形成突触时,这些蛋白质在大脑发育过程中的作用仍然未知。
针对上述问题,来自德国的研究人员详细研究了Teneurin-Latrophilin蛋白复合物的结构。使用高分辨率X射线晶体学,他们找到了有关其在早期大脑发育中的功能的更多信息。
结构分析和随后的FLRT结合模拟分析使研究人员能够识别三种蛋白质相互连接的结合位点。进一步,研究者们通过破坏这些结合位点,发现小鼠大脑中胚胎神经元的迁移行为发生了变化。 胚胎神经元通常只有一个胞体和较短的突起,称为神经突。当其中的Teneurin和FLRT与Latrophilin结合时,细胞就会发生互相排斥。这一机制导致迁移的细胞部分失去其迁移速率。但是,当在轴突表面时,Teureurin与Latrophilin相遇时不再触发排斥反应。此时此刻,蛋白质将细胞拉在一起,诱导突触的形成,并最终导致交流神经元网络的组装。 “相同的蛋白质互作导致完全不同的反应,这根本上取决于它们在细胞上的位置。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


