2019年10月CRISPR/Cas研究进展
来源:本站原创 2019-10-30 12:35
2019年10月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。 图片来自Thomas Splettstoesser (W
2019年10月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的10月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Mol Cell:基因编辑大牛张锋新力作!利用Cas13开发出经编程后杀死人细胞中RNA病毒的新技术---CARVER
doi:10.1016/j.molcel.2019.09.013
世界上许多最常见或致命的人类病原体都是RNA病毒,比如埃博拉病毒、寨卡病毒和流感病毒,并且大多数都没有美国食品药品管理局(FDA)批准的治疗方法。在一项新的研究中,来自美国麻省理工学院、哈佛大学和布罗德研究所等研究机构的研究人员将一种CRISPR RNA切割酶转变为一种经编程后检测和破坏人细胞中RNA病毒的抗病毒剂。相关研究结果于2019年10月10日在线发表在Molecular Cell期刊上,论文标题为“Programmable Inhibition and Detection of RNA Viruses Using Cas13”。

人们此前已将Cas13酶用作一种切割和编辑人类RNA的工具,并且将它用作一种检测病毒、细菌或其他靶标存在的诊断试剂。这项新的研究是首批利用Cas13或任何CRISPR系统作为体外培养的人细胞中的一种抗病毒剂的研究之一。
这些研究人员将Cas13的抗病毒活性及其诊断能力结合在一起,构建出一种有朝一日可能用于诊断和治疗病毒感染的系统。他们的系统称为CARVER(Cas13-Assisted Restriction of Viral Expression and Readout)。
布罗德研究所成员Pardis Sabeti说:“人类病毒病原体极其多样化,不断地适应它们所在的环境,即便在单一病毒种类中也是如此,这既强调了所面临的挑战,也强调了开发灵活抗病毒平台的必要性。我们的研究将CARVER确立为一种强大且可快速编程的诊断和抗病毒技术,可用于各种各样的病毒。”
2.Cell:首次发现针对III型CRISPR-Cas系统的蛋白抑制剂
doi:10.1016/j.cell.2019.09.003
在一项新的研究中,来自丹麦哥本哈根大学的研究人员发现一种针对III型CRISPR/Cas系统的抑制剂--- AcrIIIB1,它是由硫化叶菌病毒(Sulfolobus virus)SIRV2编码的。AcrIIIB1仅抑制由辅助蛋白Csx1的RNase活性介导的III-B CRISPR/Cas免疫反应。相关研究结果发表在2019年10月3日的Cell期刊上,论文标题为“Inhibition of Type III CRISPR-Cas Immunity by an Archaeal Virus-Encoded Anti-CRISPR Protein”。
这些研究人员发现AcrIIIB1似乎并不结合Csx1,但是与两种不同的III-B效应复合物--- Cmr-α和Cmr-γ相互作用。当结合前间隔序列转录本时,这两种III-B效应复合物合成环化寡腺苷酸(cyclic oligoadenylate, cOA),所产生的cOA激活Csx1的RNase活性。
综上所述,这些研究人员推断AcrIIIB1通过干扰一种Csx1 RNase相关过程来抑制III-B CRISPR/Cas免疫反应。
3.NEJM:世界首例!中国科学家找到治疗艾滋病和白血病新方法!
doi:10.1056/NEJMoa1817426
近日,一项刊登在国际杂志The New England Journal of Medicine上的研究报告中,来自北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组的研究人员通过联合研究发表了题为“CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia”(利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建)的研究论文,这项研究成果标志着世界上首例通过基因编辑干细胞治疗艾滋病和白血病患者的案例由我国科学家成功完成了!

我们都知道,如今CRISPR-Cas9基因编辑工具对哺乳动物细胞的基因组进行编辑已经被广泛使用了,该技术展现出了潜在的临床使用前途,而且目前研究人员已经开始利用该技术来探寻基于CRISPR的疗法治疗人类疾病的安全性和可行性。CCR5是HIV-1感染人体的一个保护性靶点,CCR5缺失的血细胞常常对HIV-1的感染有很大的抵抗力;有研究表明,当将携带天然CCR5突变的造血干细胞和祖细胞(HSPCs,hematopoietic stem and progenitor cells,造血干祖细胞)进行同种异体移植后(allogeneic transplantation)就能长期根除HIV-1,因为CCR5是HIV进入机体的关键共受体,这些事例或许就增加了一种可能性,即移植携带人工破坏CCR5的细胞或能作为一种新方法来制造对HIV-1感染耐受的细胞。
中国科学家的这项最新研究描述了同种异体干细胞移植后CCR5 CRISPR基因编辑的CD34+细胞的长期移植状况,其对循环骨髓细胞基因组的基因干扰比率不到8%,而且并不存在基因编辑的脱靶效应。这项长达多年的工作目前已经初步证实了基因编辑造血干细胞在临床应用中的可行性与安全性,未来将会促进和推动该技术的临床应用。未来研究人员将会继续深入研究通过各种方法来优化基因编辑造血干细胞移植方案,从而降低脱靶率,实现100%的CCR5的敲除效率。
4.Nature:细菌生物多样性促进“噬菌体耐受性”定向进化
doi:10.1038/s41586-019-1662-9
新的研究表明,在自然环境中(非实验室条件下)细菌可以通过演化产生对噬菌体感染的抵抗力。来自Exeter大学的研究者们调查了为什么铜绿假单胞菌在实验室和自然界中会以不同的方式产生对噬菌体的抗性。在实验室中,细菌的突变往往会导致噬菌体感染所依赖的附着受体的缺陷。而在自然环境中,细菌倾向于使用被称为CRISPR-Cas的免疫机制产生抵抗力。
虽然该研究仍旧是在实验室中进行的,但是通过将铜绿假单胞菌与其它类型的细菌混合培养用以模拟“自然条件”,研究人员表明,这种额外的“生物复杂性”有助于平衡基于CRISPR的噬菌体耐受性。
研究者们发现,与失去噬菌体受体的进化不同,这种基于CRISPR的噬菌体抗性不会降低细菌的毒力。“当我们引入生物多样性时,细菌更偏向于基于CRISPR的进化,”该研究的主要作者Ellinor Alseth说:“在自然的环境中,失去表面受体(噬菌体所附着的)是有代价的,因为该分子对于细菌本身可能还具有其它功能。如果丧失这种表面受体,那么与其他种类的细菌相比,突变菌的竞争力将会变低,从而不适于生存。因此,在更复杂的,更'自然'的环境中,基于CRISPR的抗性受到细菌的青睐。”
5.Nature:新一代CRISPR基因编辑技术诞生,或为人体细胞提供多种功能
doi:10.1038/s41586-019-1711-4
近日,来自美国布罗德研究所的科学家们通开发了一种新的CRISPR基因组编辑方法,能够进一步提高基因编辑的效率与准确性。该系统称为“prime editing”,能够以精确,高效和高度通用的方式直接编辑人体细胞。该方法扩大了生物学和治疗学研究的基因编辑范围,并有可能校正多达89%的已知致病基因变异。相关结果发表在最近的《Nature》杂志上。该研究第一作者为Andrew Anzalone。

“prime editing”不同于以前的基因组编辑系统。Cas9蛋白是最早在人类细胞中进行基因组编辑的CRISPR工具,它是由布罗德研究所,麻省理工学院和哈佛大学率先开发。Cas9能够切割DNA链,从而可以在特定位置破坏靶基因,然后通过将新的DNA重组到靶位点而添加新的序列。这项由Liu等人开发的“prime editing”工具,是在原有CRISPR-Cas9技术的基础上将Cas9进一步融合到另外一个蛋白质上。后者可以进行特殊的生化反应,将一个DNA碱基进行转换。目前开发出的蛋白质可以有效地进行四种类型的碱基转换:C到T,T到C,A到G和G到A。
该编辑系统的另一大特色是将Cas9与另一种称为逆转录酶的蛋白质偶联。该复合物将目标DNA区域的其中一条链变为“prime”链,从而能够定向地进行基因序列编辑。这些作者使用了一种新型的工程化sgRNA,称为pegRNA,可将“prime editing”工具引导至其靶位点,在该位点,经过修饰的Cas9会切割DNA的一条链。 pegRNA还包含能够编码新序列的RNA片段。逆转录酶元件通过读取RNA信息并将相应的DNA“写入”靶点区域。
在《自然》杂志的论文中,研究小组证明了prime editing技术能够通过基因编辑的方式准确校正导致镰状细胞性贫血的基因变异。“通过初步编辑,我们现在可以将镰状细胞贫血突变直接改回正常序列,并去除引起泰-萨克斯病(Tay Sachs disease)的四个额外的DNA碱基,而无需完全切割DNA或需要DNA模板,” Liu说:“该系统的优点在于对编辑的序列几乎没有限制。由于添加的核苷酸由pegRNA指定,因此它们与prime链即使仅仅只有一个碱基的差异,也能够做到准确识别。”
6.Nat Immunol:突破!新型系统或能帮助机体免疫系统有效寻找并杀灭隐藏的癌细胞!
doi:10.1038/s41590-019-0500-4
癌细胞往往是躲避宿主机体检测的“大师”;近日,一项刊登在国际杂志Nature Immunology上的研究报告中,来自耶鲁大学的科学家们通过研究开发了一种新系统,其能够帮助寻找隐藏的癌细胞,促进机体免疫系统定位并清除免疫疗法后遗漏的癌细胞。
这种新系统能减少或消除小鼠机体中的黑色素瘤、三阴性乳腺癌肿瘤和胰腺肿瘤,甚至还包括一些距离原发性肿瘤位点较远的肿瘤组织。研究者Sidi Chen教授表示,这是一种全新的免疫疗法;免疫疗法给癌症治疗带来了革命性的进展,但当前很多疗法并不能针对所有患者发挥作用,同时也只能治疗部分癌症类型;现有的治疗手段有时并不能识别癌细胞的所有分子伪装,这就使得疗法治疗效果会变差。
为了解决这些问题,这项研究中,研究人员开发了一种新系统,其能将病毒基因疗法和CRISPR基因编辑技术相结合,代替了寻找并编辑DNA并插入新基因,这种名为MAEGI(内源性基因的多重激活作为免疫疗法,Multiplexed Activation of Endogenous Genes as Immunotherapy)的新系统能对成千上万个癌症相关基因进行大规模搜索,同时像GPS一样定位并放大信号。MAEGI能对肿瘤细胞进行标记并进行免疫摧毁,其能将冷肿瘤(缺乏免疫细胞)转化为热肿瘤(携带免疫细胞),研究者Chen表示,这相当于给肿瘤细胞穿上了橙色的防弹衣,促进机体免疫系统警察迅速找到并消灭这些癌细胞。一旦癌细胞被识别,宿主机体免疫系统就能快速对其进行摧毁消灭。
7.Mol Ther:科学家有望利用CRISPR-Cas9技术成功治疗宫颈癌
doi:10.1016/j.ymthe.2019.08.012
最近,一项刊登在国际杂志Molecular Therapy上的研究报告中,来自格里菲斯大学的科学家们通过研究借助CRISPR-Cas9技术利用隐形纳米颗粒成功在体内靶向作用并对小鼠的宫颈癌进行了治疗。
研究者Nigel McMillan教授说道,这是我们第一次使用基因编辑技术来成功治疗癌症的例子;这种隐形纳米颗粒能够寻找癌细胞中的致癌基因,同时通过引入一些额外的DNA来对其进行编辑,这些额外的DNA能够促进致癌基因误读并停止转录翻译;这就好比是在一个单词中添加几个额外的字母,所以拼写检查器并不会将其识别为“anyTTmore”,因为癌症必须由这个基因来产生,一旦被进行了编辑,癌细胞就会死亡。
这项研究中,研究者所治疗的小鼠存活率达到了100%,而且其机体中并没有任何肿瘤痕迹,这些小鼠也并没有其它临床迹象,比如来自疗法的炎症等,但其可能还有其它基因改变研究人员并未测到。一旦研究人员知道了正确的基因,其它癌症就能够得到有效治疗;近乎所有的宫颈癌都是由人类乳头瘤病毒(HPV)所引起,每年都有超过250名澳大利亚女性因宫颈癌而死亡。
8.Nat Biotechnol:基因编辑免疫细胞攻击胶质母细胞瘤
doi:10.1038/s41587-019-0246-4
耶鲁大学系统生物学研究所和耶鲁癌症中心的遗传学助理教授Sidi Chen实验室开发了一种先进的基因编辑和筛选技术,可以为癌症免疫治疗寻找新的靶点。于近日发表在《自然生物技术》(Nature Biotechnology)杂志上的一项新研究中,Chen和同事们报告说,在小鼠胶质母细胞瘤模型中,使用含有这些基因靶点修饰的T细胞可以让肿瘤生长变慢。而胶质母细胞瘤是一种特别难以治疗的脑癌。
研究人员指出,大脑的免疫系统活动非常有限,因此不是一个特别有希望的免疫治疗器官。陈的实验室开发了一种复杂的病毒载体,内含转座子或跳跃基因,有助于T细胞的基因筛选能力。T细胞的基因组筛选揭示了一个目标--PDIA3,当在T细胞中的PDIA3受到抑制时,可以抑制小鼠胶质母细胞瘤的生长。研究人员还表明,在特定类型的T细胞中敲除PDIA3可以增强它们在人类胶质母细胞瘤细胞中的抗癌特性。
9.PNAS:构建出提高CRISPR-Cas9基因编辑精确度的新变体---SaCas9-HF
doi:10.1073/pnas.1906843116
在一项新的研究中,来自中国香港城市大学的研究人员开发出基因编辑技术CRISPR-Cas9的一种新变体,它有潜力在人类基因治疗期间提高基因编辑的精确度。相比于野生型CRISPR-Cas9,这种新变体降低了DNA中出现的意外变化,这表明它可能在需要高精确度的基因疗法中发挥作用。相关研究结果近期发表在PNAS期刊上,论文标题为“Rationally engineered Staphylococcus aureus Cas9 nucleases with high genome-wide specificity”。
这些研究人员鉴定出一种命名为SaCas9-HF的基因改造变体,它在实验室环境中可显著提高人细胞中24个基因组位点的基因靶向准确性。对于高度相似的基因序列,SaCas9-HF将脱靶活性降低了大约90%,然而当使用野生型SaCas9时,这往往导致意料之外的编辑。对于通常具有较少编辑失误的基因序列,SaCas9-HF具有几乎无法检测到的脱靶活性。
香港城市大学的Zongli Zheng博士说,“我们的发现为野生型Cas9工具提供了一种替代方案---在需要高度精确的基因组编辑时使用这种Cas9变体。这种新的核酸酶对在未来使用AAV在体内递送基因组编辑组分进行的基因疗法特别有用。”
10.PNAS:开发出在基因编辑时阻止基因组不稳定的CRISPR-BEST技术
doi:10.1073/pnas.1913493116
尽管CRISPR技术允许对基因组进行更好的操纵,并对现代药物开发和更好的新型抗生素的发现产生许多积极影响,但是当使用该技术时,仍然存在诸如基因组不稳定和Cas9蛋白毒性等重大问题。
不过,在一项新的研究中,来自丹麦技术大学的研究人员开发出一种称为CRISPR-BEST的新工具,它有望成为CRISPR工具箱中的新成员。这种工具可以在不需要引入DNA双链断裂的情况下高效地在放线菌中产生突变。相关研究结果近期发表在PNAS期刊上,论文标题为“Highly efficient DSB-free base editing for streptomycetes with CRISPR-BEST”。
因此,CRISPR-BEST系统解决了放线菌基因工程所面临的一项重大挑战,这是因为引入DNA双链断裂经常导致基因组不稳定,这就迫使放线菌发生重排,或者甚至剔除较大的染色体片段---这是当对细胞进行基因改造以便产生物活性化合物和新型抗生素时想要避免的一种现象。
11.Nat Commun:利用CRISPR技术改造微生物组
doi:10.1038/s41467-019-12448-3
最近,来自Western大学的研究人员开发了一种将DNA编辑工具CRISPR-Cas9应用于改造实验室微生物的新方法,从而提供了一种有效地对特定细菌发起针对性攻击的方法。今天发表在《Nature Communications》杂志上的这项研究开辟了使用CRISPR改变人体微生物组组成的可能性,这种方式可以因人而异。它还提供了替代传统抗生素的潜在疗法,可以杀死诸如金黄色葡萄球菌(Staph A)或大肠杆菌(E. coli)在内的细菌。
Schulich Medicine&Dentistry教授David Edgell表示:“使用CRISPR杀伤细菌并不是什么新主意,因为这正是CRISPR本来的用途。然而,问题是如何将CRISPR送到目标位置。其他传递系统只能到达几个特定地点,而我们的新方法可以将其传递到任何地方。包括CRISPR在内的任何治疗手段的最大瓶颈之一都是特异性的问题。通过开发这种新的递送系统,我们创造了新的工具,可以在不久的将来帮助我们开发更有效的疗法”。
12.Nat Biotechnol:利用I型CRISPR/Cas系统对人细胞进行靶向转录调节
doi:10.1038/s41587-019-0235-7
在一项新的研究中,美国杜克大学生物医学工程副教授Charles Gersbach、Gersbach实验室博士后研究员Adrian Oliver及其团队首次描述了他们如何成功地利用I型CRISPR系统开启和关闭基因,并对人细胞中的表观基因组进行编辑。他们希望这能够极大地扩展生物医学工程师可用的基于CRISPR的工具,从而开启一个多样化的基因组工程技术新领域。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“Targeted transcriptional modulation with type I CRISPR–Cas systems in human cells”。
为了探寻I型CRISPR系统的功能,Oliver将基因活化剂连接到了大肠杆菌I型Cascade复合物的特定位点上,从而让这种系统靶向结合调节基因表达水平的启动子。鉴于她在实验中没有使用Cas3蛋白,因此不存在DNA切割,也就不会改变DNA序列。这项实验表明这种Cascade活化剂不仅结合正确的位点,而且可以提高靶基因的表达水平,而且这样做的准确性和特异性与CRISPR/Cas9相当。
Oliver使用来自另一种细菌菌株的I型Cascade复合物重复了该过程,结果发现它能够在多个靶位点上强效地发挥作用。她还发现可以将这种活化结构域(即前面的活化剂)替换为阻遏物,从而关闭靶基因。这些研究人员再次指出,这种方法的准确性和特异性可与CRISPR/Cas9方法媲美。(生物谷 Bioon.com)

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
即将过去的10月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Mol Cell:基因编辑大牛张锋新力作!利用Cas13开发出经编程后杀死人细胞中RNA病毒的新技术---CARVER
doi:10.1016/j.molcel.2019.09.013
世界上许多最常见或致命的人类病原体都是RNA病毒,比如埃博拉病毒、寨卡病毒和流感病毒,并且大多数都没有美国食品药品管理局(FDA)批准的治疗方法。在一项新的研究中,来自美国麻省理工学院、哈佛大学和布罗德研究所等研究机构的研究人员将一种CRISPR RNA切割酶转变为一种经编程后检测和破坏人细胞中RNA病毒的抗病毒剂。相关研究结果于2019年10月10日在线发表在Molecular Cell期刊上,论文标题为“Programmable Inhibition and Detection of RNA Viruses Using Cas13”。

图片来自Mulepati, S., Bailey, S.; Astrojan/Wikipedia/ CC BY 3.0。
人们此前已将Cas13酶用作一种切割和编辑人类RNA的工具,并且将它用作一种检测病毒、细菌或其他靶标存在的诊断试剂。这项新的研究是首批利用Cas13或任何CRISPR系统作为体外培养的人细胞中的一种抗病毒剂的研究之一。
这些研究人员将Cas13的抗病毒活性及其诊断能力结合在一起,构建出一种有朝一日可能用于诊断和治疗病毒感染的系统。他们的系统称为CARVER(Cas13-Assisted Restriction of Viral Expression and Readout)。
布罗德研究所成员Pardis Sabeti说:“人类病毒病原体极其多样化,不断地适应它们所在的环境,即便在单一病毒种类中也是如此,这既强调了所面临的挑战,也强调了开发灵活抗病毒平台的必要性。我们的研究将CARVER确立为一种强大且可快速编程的诊断和抗病毒技术,可用于各种各样的病毒。”
2.Cell:首次发现针对III型CRISPR-Cas系统的蛋白抑制剂
doi:10.1016/j.cell.2019.09.003
在一项新的研究中,来自丹麦哥本哈根大学的研究人员发现一种针对III型CRISPR/Cas系统的抑制剂--- AcrIIIB1,它是由硫化叶菌病毒(Sulfolobus virus)SIRV2编码的。AcrIIIB1仅抑制由辅助蛋白Csx1的RNase活性介导的III-B CRISPR/Cas免疫反应。相关研究结果发表在2019年10月3日的Cell期刊上,论文标题为“Inhibition of Type III CRISPR-Cas Immunity by an Archaeal Virus-Encoded Anti-CRISPR Protein”。
这些研究人员发现AcrIIIB1似乎并不结合Csx1,但是与两种不同的III-B效应复合物--- Cmr-α和Cmr-γ相互作用。当结合前间隔序列转录本时,这两种III-B效应复合物合成环化寡腺苷酸(cyclic oligoadenylate, cOA),所产生的cOA激活Csx1的RNase活性。
综上所述,这些研究人员推断AcrIIIB1通过干扰一种Csx1 RNase相关过程来抑制III-B CRISPR/Cas免疫反应。
3.NEJM:世界首例!中国科学家找到治疗艾滋病和白血病新方法!
doi:10.1056/NEJMoa1817426
近日,一项刊登在国际杂志The New England Journal of Medicine上的研究报告中,来自北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组的研究人员通过联合研究发表了题为“CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia”(利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建)的研究论文,这项研究成果标志着世界上首例通过基因编辑干细胞治疗艾滋病和白血病患者的案例由我国科学家成功完成了!

图片来源:Lei Xu et al. N Engl J Med 2019 DOI:10.1056/NEJMoa1817426。
我们都知道,如今CRISPR-Cas9基因编辑工具对哺乳动物细胞的基因组进行编辑已经被广泛使用了,该技术展现出了潜在的临床使用前途,而且目前研究人员已经开始利用该技术来探寻基于CRISPR的疗法治疗人类疾病的安全性和可行性。CCR5是HIV-1感染人体的一个保护性靶点,CCR5缺失的血细胞常常对HIV-1的感染有很大的抵抗力;有研究表明,当将携带天然CCR5突变的造血干细胞和祖细胞(HSPCs,hematopoietic stem and progenitor cells,造血干祖细胞)进行同种异体移植后(allogeneic transplantation)就能长期根除HIV-1,因为CCR5是HIV进入机体的关键共受体,这些事例或许就增加了一种可能性,即移植携带人工破坏CCR5的细胞或能作为一种新方法来制造对HIV-1感染耐受的细胞。
中国科学家的这项最新研究描述了同种异体干细胞移植后CCR5 CRISPR基因编辑的CD34+细胞的长期移植状况,其对循环骨髓细胞基因组的基因干扰比率不到8%,而且并不存在基因编辑的脱靶效应。这项长达多年的工作目前已经初步证实了基因编辑造血干细胞在临床应用中的可行性与安全性,未来将会促进和推动该技术的临床应用。未来研究人员将会继续深入研究通过各种方法来优化基因编辑造血干细胞移植方案,从而降低脱靶率,实现100%的CCR5的敲除效率。
4.Nature:细菌生物多样性促进“噬菌体耐受性”定向进化
doi:10.1038/s41586-019-1662-9
新的研究表明,在自然环境中(非实验室条件下)细菌可以通过演化产生对噬菌体感染的抵抗力。来自Exeter大学的研究者们调查了为什么铜绿假单胞菌在实验室和自然界中会以不同的方式产生对噬菌体的抗性。在实验室中,细菌的突变往往会导致噬菌体感染所依赖的附着受体的缺陷。而在自然环境中,细菌倾向于使用被称为CRISPR-Cas的免疫机制产生抵抗力。
虽然该研究仍旧是在实验室中进行的,但是通过将铜绿假单胞菌与其它类型的细菌混合培养用以模拟“自然条件”,研究人员表明,这种额外的“生物复杂性”有助于平衡基于CRISPR的噬菌体耐受性。
研究者们发现,与失去噬菌体受体的进化不同,这种基于CRISPR的噬菌体抗性不会降低细菌的毒力。“当我们引入生物多样性时,细菌更偏向于基于CRISPR的进化,”该研究的主要作者Ellinor Alseth说:“在自然的环境中,失去表面受体(噬菌体所附着的)是有代价的,因为该分子对于细菌本身可能还具有其它功能。如果丧失这种表面受体,那么与其他种类的细菌相比,突变菌的竞争力将会变低,从而不适于生存。因此,在更复杂的,更'自然'的环境中,基于CRISPR的抗性受到细菌的青睐。”
5.Nature:新一代CRISPR基因编辑技术诞生,或为人体细胞提供多种功能
doi:10.1038/s41586-019-1711-4
近日,来自美国布罗德研究所的科学家们通开发了一种新的CRISPR基因组编辑方法,能够进一步提高基因编辑的效率与准确性。该系统称为“prime editing”,能够以精确,高效和高度通用的方式直接编辑人体细胞。该方法扩大了生物学和治疗学研究的基因编辑范围,并有可能校正多达89%的已知致病基因变异。相关结果发表在最近的《Nature》杂志上。该研究第一作者为Andrew Anzalone。

图片来源:Www.pixabay.com。
“prime editing”不同于以前的基因组编辑系统。Cas9蛋白是最早在人类细胞中进行基因组编辑的CRISPR工具,它是由布罗德研究所,麻省理工学院和哈佛大学率先开发。Cas9能够切割DNA链,从而可以在特定位置破坏靶基因,然后通过将新的DNA重组到靶位点而添加新的序列。这项由Liu等人开发的“prime editing”工具,是在原有CRISPR-Cas9技术的基础上将Cas9进一步融合到另外一个蛋白质上。后者可以进行特殊的生化反应,将一个DNA碱基进行转换。目前开发出的蛋白质可以有效地进行四种类型的碱基转换:C到T,T到C,A到G和G到A。
该编辑系统的另一大特色是将Cas9与另一种称为逆转录酶的蛋白质偶联。该复合物将目标DNA区域的其中一条链变为“prime”链,从而能够定向地进行基因序列编辑。这些作者使用了一种新型的工程化sgRNA,称为pegRNA,可将“prime editing”工具引导至其靶位点,在该位点,经过修饰的Cas9会切割DNA的一条链。 pegRNA还包含能够编码新序列的RNA片段。逆转录酶元件通过读取RNA信息并将相应的DNA“写入”靶点区域。
在《自然》杂志的论文中,研究小组证明了prime editing技术能够通过基因编辑的方式准确校正导致镰状细胞性贫血的基因变异。“通过初步编辑,我们现在可以将镰状细胞贫血突变直接改回正常序列,并去除引起泰-萨克斯病(Tay Sachs disease)的四个额外的DNA碱基,而无需完全切割DNA或需要DNA模板,” Liu说:“该系统的优点在于对编辑的序列几乎没有限制。由于添加的核苷酸由pegRNA指定,因此它们与prime链即使仅仅只有一个碱基的差异,也能够做到准确识别。”
6.Nat Immunol:突破!新型系统或能帮助机体免疫系统有效寻找并杀灭隐藏的癌细胞!
doi:10.1038/s41590-019-0500-4
癌细胞往往是躲避宿主机体检测的“大师”;近日,一项刊登在国际杂志Nature Immunology上的研究报告中,来自耶鲁大学的科学家们通过研究开发了一种新系统,其能够帮助寻找隐藏的癌细胞,促进机体免疫系统定位并清除免疫疗法后遗漏的癌细胞。
这种新系统能减少或消除小鼠机体中的黑色素瘤、三阴性乳腺癌肿瘤和胰腺肿瘤,甚至还包括一些距离原发性肿瘤位点较远的肿瘤组织。研究者Sidi Chen教授表示,这是一种全新的免疫疗法;免疫疗法给癌症治疗带来了革命性的进展,但当前很多疗法并不能针对所有患者发挥作用,同时也只能治疗部分癌症类型;现有的治疗手段有时并不能识别癌细胞的所有分子伪装,这就使得疗法治疗效果会变差。
为了解决这些问题,这项研究中,研究人员开发了一种新系统,其能将病毒基因疗法和CRISPR基因编辑技术相结合,代替了寻找并编辑DNA并插入新基因,这种名为MAEGI(内源性基因的多重激活作为免疫疗法,Multiplexed Activation of Endogenous Genes as Immunotherapy)的新系统能对成千上万个癌症相关基因进行大规模搜索,同时像GPS一样定位并放大信号。MAEGI能对肿瘤细胞进行标记并进行免疫摧毁,其能将冷肿瘤(缺乏免疫细胞)转化为热肿瘤(携带免疫细胞),研究者Chen表示,这相当于给肿瘤细胞穿上了橙色的防弹衣,促进机体免疫系统警察迅速找到并消灭这些癌细胞。一旦癌细胞被识别,宿主机体免疫系统就能快速对其进行摧毁消灭。
7.Mol Ther:科学家有望利用CRISPR-Cas9技术成功治疗宫颈癌
doi:10.1016/j.ymthe.2019.08.012
最近,一项刊登在国际杂志Molecular Therapy上的研究报告中,来自格里菲斯大学的科学家们通过研究借助CRISPR-Cas9技术利用隐形纳米颗粒成功在体内靶向作用并对小鼠的宫颈癌进行了治疗。
研究者Nigel McMillan教授说道,这是我们第一次使用基因编辑技术来成功治疗癌症的例子;这种隐形纳米颗粒能够寻找癌细胞中的致癌基因,同时通过引入一些额外的DNA来对其进行编辑,这些额外的DNA能够促进致癌基因误读并停止转录翻译;这就好比是在一个单词中添加几个额外的字母,所以拼写检查器并不会将其识别为“anyTTmore”,因为癌症必须由这个基因来产生,一旦被进行了编辑,癌细胞就会死亡。
这项研究中,研究者所治疗的小鼠存活率达到了100%,而且其机体中并没有任何肿瘤痕迹,这些小鼠也并没有其它临床迹象,比如来自疗法的炎症等,但其可能还有其它基因改变研究人员并未测到。一旦研究人员知道了正确的基因,其它癌症就能够得到有效治疗;近乎所有的宫颈癌都是由人类乳头瘤病毒(HPV)所引起,每年都有超过250名澳大利亚女性因宫颈癌而死亡。
8.Nat Biotechnol:基因编辑免疫细胞攻击胶质母细胞瘤
doi:10.1038/s41587-019-0246-4
耶鲁大学系统生物学研究所和耶鲁癌症中心的遗传学助理教授Sidi Chen实验室开发了一种先进的基因编辑和筛选技术,可以为癌症免疫治疗寻找新的靶点。于近日发表在《自然生物技术》(Nature Biotechnology)杂志上的一项新研究中,Chen和同事们报告说,在小鼠胶质母细胞瘤模型中,使用含有这些基因靶点修饰的T细胞可以让肿瘤生长变慢。而胶质母细胞瘤是一种特别难以治疗的脑癌。

图片来源:Nature Biotechnology。
研究人员指出,大脑的免疫系统活动非常有限,因此不是一个特别有希望的免疫治疗器官。陈的实验室开发了一种复杂的病毒载体,内含转座子或跳跃基因,有助于T细胞的基因筛选能力。T细胞的基因组筛选揭示了一个目标--PDIA3,当在T细胞中的PDIA3受到抑制时,可以抑制小鼠胶质母细胞瘤的生长。研究人员还表明,在特定类型的T细胞中敲除PDIA3可以增强它们在人类胶质母细胞瘤细胞中的抗癌特性。
9.PNAS:构建出提高CRISPR-Cas9基因编辑精确度的新变体---SaCas9-HF
doi:10.1073/pnas.1906843116
在一项新的研究中,来自中国香港城市大学的研究人员开发出基因编辑技术CRISPR-Cas9的一种新变体,它有潜力在人类基因治疗期间提高基因编辑的精确度。相比于野生型CRISPR-Cas9,这种新变体降低了DNA中出现的意外变化,这表明它可能在需要高精确度的基因疗法中发挥作用。相关研究结果近期发表在PNAS期刊上,论文标题为“Rationally engineered Staphylococcus aureus Cas9 nucleases with high genome-wide specificity”。
这些研究人员鉴定出一种命名为SaCas9-HF的基因改造变体,它在实验室环境中可显著提高人细胞中24个基因组位点的基因靶向准确性。对于高度相似的基因序列,SaCas9-HF将脱靶活性降低了大约90%,然而当使用野生型SaCas9时,这往往导致意料之外的编辑。对于通常具有较少编辑失误的基因序列,SaCas9-HF具有几乎无法检测到的脱靶活性。
香港城市大学的Zongli Zheng博士说,“我们的发现为野生型Cas9工具提供了一种替代方案---在需要高度精确的基因组编辑时使用这种Cas9变体。这种新的核酸酶对在未来使用AAV在体内递送基因组编辑组分进行的基因疗法特别有用。”
10.PNAS:开发出在基因编辑时阻止基因组不稳定的CRISPR-BEST技术
doi:10.1073/pnas.1913493116
尽管CRISPR技术允许对基因组进行更好的操纵,并对现代药物开发和更好的新型抗生素的发现产生许多积极影响,但是当使用该技术时,仍然存在诸如基因组不稳定和Cas9蛋白毒性等重大问题。
不过,在一项新的研究中,来自丹麦技术大学的研究人员开发出一种称为CRISPR-BEST的新工具,它有望成为CRISPR工具箱中的新成员。这种工具可以在不需要引入DNA双链断裂的情况下高效地在放线菌中产生突变。相关研究结果近期发表在PNAS期刊上,论文标题为“Highly efficient DSB-free base editing for streptomycetes with CRISPR-BEST”。
因此,CRISPR-BEST系统解决了放线菌基因工程所面临的一项重大挑战,这是因为引入DNA双链断裂经常导致基因组不稳定,这就迫使放线菌发生重排,或者甚至剔除较大的染色体片段---这是当对细胞进行基因改造以便产生物活性化合物和新型抗生素时想要避免的一种现象。
11.Nat Commun:利用CRISPR技术改造微生物组
doi:10.1038/s41467-019-12448-3
最近,来自Western大学的研究人员开发了一种将DNA编辑工具CRISPR-Cas9应用于改造实验室微生物的新方法,从而提供了一种有效地对特定细菌发起针对性攻击的方法。今天发表在《Nature Communications》杂志上的这项研究开辟了使用CRISPR改变人体微生物组组成的可能性,这种方式可以因人而异。它还提供了替代传统抗生素的潜在疗法,可以杀死诸如金黄色葡萄球菌(Staph A)或大肠杆菌(E. coli)在内的细菌。
Schulich Medicine&Dentistry教授David Edgell表示:“使用CRISPR杀伤细菌并不是什么新主意,因为这正是CRISPR本来的用途。然而,问题是如何将CRISPR送到目标位置。其他传递系统只能到达几个特定地点,而我们的新方法可以将其传递到任何地方。包括CRISPR在内的任何治疗手段的最大瓶颈之一都是特异性的问题。通过开发这种新的递送系统,我们创造了新的工具,可以在不久的将来帮助我们开发更有效的疗法”。
12.Nat Biotechnol:利用I型CRISPR/Cas系统对人细胞进行靶向转录调节
doi:10.1038/s41587-019-0235-7
在一项新的研究中,美国杜克大学生物医学工程副教授Charles Gersbach、Gersbach实验室博士后研究员Adrian Oliver及其团队首次描述了他们如何成功地利用I型CRISPR系统开启和关闭基因,并对人细胞中的表观基因组进行编辑。他们希望这能够极大地扩展生物医学工程师可用的基于CRISPR的工具,从而开启一个多样化的基因组工程技术新领域。相关研究结果近期发表在Nature Biotechnology期刊上,论文标题为“Targeted transcriptional modulation with type I CRISPR–Cas systems in human cells”。

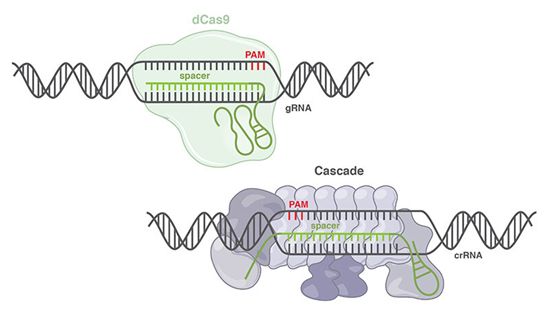
示意图指出常见的dCas9系统(上面)和Cascade系统(下面)的组分,图片来自Gersbach Lab。
为了探寻I型CRISPR系统的功能,Oliver将基因活化剂连接到了大肠杆菌I型Cascade复合物的特定位点上,从而让这种系统靶向结合调节基因表达水平的启动子。鉴于她在实验中没有使用Cas3蛋白,因此不存在DNA切割,也就不会改变DNA序列。这项实验表明这种Cascade活化剂不仅结合正确的位点,而且可以提高靶基因的表达水平,而且这样做的准确性和特异性与CRISPR/Cas9相当。
Oliver使用来自另一种细菌菌株的I型Cascade复合物重复了该过程,结果发现它能够在多个靶位点上强效地发挥作用。她还发现可以将这种活化结构域(即前面的活化剂)替换为阻遏物,从而关闭靶基因。这些研究人员再次指出,这种方法的准确性和特异性可与CRISPR/Cas9方法媲美。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


