黑色素瘤研究进展一览
来源:本站原创 2019-10-27 01:40
2019年10月27日 讯 /生物谷BIOON/ --本期为大家带来的是生物谷往期介绍的黑色素瘤相关研究的盘点,希望读者朋友们能够喜欢。1. NEJM重磅消息:联合免疫治疗显著提高黑色素瘤患者长期生存率DOI: 10.1056/NEJMoa1910836根据皇家马斯登NHS基金会的一项研究,两种免疫治疗药物的组合--ipilimumab和nivolumab--已经在五年内或更长的时间里阻止或逆转了
2019年10月27日 讯 /生物谷BIOON/ --本期为大家带来的是生物谷往期介绍的黑色素瘤相关研究的盘点,希望读者朋友们能够喜欢。
1. NEJM重磅消息:联合免疫治疗显著提高黑色素瘤患者长期生存率
DOI: 10.1056/NEJMoa1910836
根据皇家马斯登NHS基金会的一项研究,两种免疫治疗药物的组合--ipilimumab和nivolumab--已经在五年内或更长的时间里阻止或逆转了晚期黑色素瘤的进展。
就在10年前,只有1 / 20的晚期黑素瘤患者能存活5年,而许多患者只能存活6到9个月。Checkmate 067 trial的结果于近日在西班牙巴塞罗那举行的2019年ESMO年会上公布,并同时发表在《新英格兰医学杂志》(The New England Journal of Medicine)上,这是检查点抑制剂联合治疗的最长的3期随访临床实验。
皇家马斯登NHS基金会的肿瘤顾问、英国癌症研究所(ICR)的教授James Larkin介绍了研究结果,他说:"在过去,转移性黑色素瘤被认为是不可治愈的。肿瘤学家认为黑素瘤与其他癌症不同,一旦扩散就无法治疗。这是我们第一次可以说,晚期黑色素瘤长期幸存者的几率现在超过50%,这是一个巨大的里程碑。"
该试验将945名晚期黑色素瘤患者随机分为三组:314名患者接受了nivolumab和ipilimumab的"双重打击";316名患者接受了nivolumab+安慰剂治疗;315名患者接受ipilimumab +安慰剂治疗。每个nivolumab单独与ipilimumab进行比较,直到疾病进展或任何副作用变得不可接受为止。
nivolumab联合ipilimumab的5年总生存率为52%,其中74%的患者5年后无治疗。nivolumab的总生存率为44%,ipilimumab的总生存率为26%。
Larkin教授表示:"把这两种药物放在一起,你实际上是在给免疫系统踩下两个刹车,而不是一个。这样,免疫系统就能够识别它之前没有识别出的肿瘤,并做出反应,摧毁它们。"
重要的是,对于那些因为疲劳、皮疹和腹泻等副作用而停止治疗的患者,结果与那些长期服用联合用药的患者一样好。关于免疫疗法的一个关键点是,即使治疗时间很短,免疫系统也可以被重新教育。这与其他治疗如化疗形成对比,化疗需要一个完整的疗程才能达到同样的效果。
67岁的Pamela Smith在发现自己的黑色素瘤扩散后不久,于2014年1月参加了Checkmate 067临床试验。
Pamela说:"当时无法动手术,所以这次试验是我唯一的选择。我每两周接受一次治疗,持续了大约四个月,结果我得了严重的腹泻,不得不停止治疗。令人惊讶的是,第一次扫描和此后的每次扫描都表明,在相对较短的时间内,它成功了。我的肿瘤缩小到原来的一半不到,而且五年来没有变化。从那以后我再也没有接受过任何治疗,我感觉棒极了。"
2. Cell:黑色素瘤的异质性阻碍了有效的免疫反应
doi:10.1016/j.cell.2019.08.032.
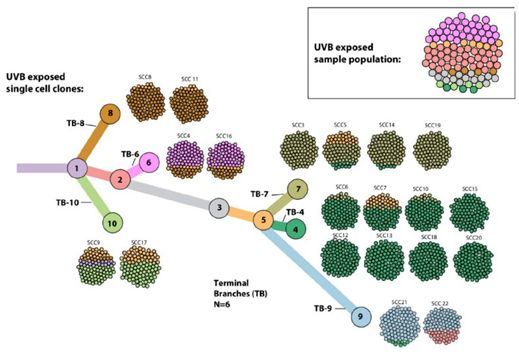
在一项新的研究中,来自以色列魏茨曼科学研究所和美国国家癌症研究所等研究机构的研究人员发现在黑色素瘤中,如果肿瘤中的细胞能够分化为更加多样化的亚型,那么它就不太可能受到免疫系统的影响,这就降低了免疫疗法发挥疗效的机会。这些研究结果可能为设计针对癌症患者的个性化治疗方案提供了更好的工具,并且为研发抗癌疫苗指明了新的途径。相关研究结果近期发表在Cell期刊上,论文标题为“UVB-Induced Tumor Heterogeneity Diminishes Immune Response in Melanoma”。
尽管近年来由于采用了新的免疫疗法,黑色素瘤导致的癌症死亡人数有所下降,但是许多患者对这种疗法没有反应。基于此,论文共同通讯作者、魏茨曼科学研究所分子细胞生物学系的Yardena Samuels教授想要知道其中的原因。这种原因尚不清楚,不过一些研究支持的主要假设是具有更多突变的肿瘤---更高的“肿瘤突变负担(tumor mutational burden)”---更可能对免疫疗法作出反应。一些患者甚至花费大量资金进行放疗或化疗以增加肿瘤突变,但是这两者之间的因果关系尚未得到证实。Samuels和她的同事们对那些提出了一种不同的可能相关性---异质性(即肿瘤细胞之间的遗传多样性)和治疗反应之间的相关性---的研究很感兴趣。然而,若要研究这一理论,Samuels及其团队必须开发一种新的实验性系统,以准确地研究哪些因素起作用。
在这项研究中,在Samuels实验室的Yochai Wolf和Osnat Bartok的领导下,这些研究人员获取了小鼠黑色素瘤细胞,并将它们暴露于一种已知会促进这种癌症的紫外线下。这增加了肿瘤中的突变和细胞异质性。当他们给小鼠注射这些细胞或常规的黑色素瘤细胞时,受紫外线照射的黑色素瘤细胞增殖得更快,并且更具侵袭性。尽管这些细胞具有较高的突变负担,因而对免疫疗法作出更高的反应性,但实际上与原始肿瘤相比,它们被根除的可能性较小。换句话说,尽管具有较高的突变负担,但是异质性也很高,他们推测后者正在促进治疗抵抗性产生。
鉴于突变负担和异质性通常是并存的,这些研究人员需要找到一种方法来研究这两者之间的差异。他们从恶性肿瘤的培养物中提取出单个细胞,然后利用每个细胞生长出新的培养物。因此,他们最终获得了22种新的细胞培养物,每种细胞培养物具有较低的异质性但带有一定随机数量的突变。
当这些研究人员将这些细胞培养物注射到小鼠体内时,他们吃惊地发现,在突变负荷较高或较低的小鼠中,所有的肿瘤都生长缓慢,甚至在没有免疫疗法的情况下就消失了。为了确定小鼠的免疫系统是否确实负责杀死癌细胞,他们在免疫系统减弱的小鼠中重复了该实验。在这些小鼠中,癌症快速地扩散。
为了进一步了解这种免疫反应,这些研究人员再次尝试了该实验,它是在经过特定基因改造后缺乏T细胞的小鼠---已知抵抗癌症的免疫细胞---中进行的。Wolf说:“这些结果类似于在免疫系统减弱的小鼠中观察到的情形。当我们观察来自不同肿瘤的T细胞时,我们发现在同质性肿瘤(homogenous growths)中有更多的T细胞活性,而在异质性肿瘤中具有更少的T细胞活性。”实际上,这些研究人员发现,在同质性肿瘤中,T细胞已渗透到肿瘤的中心,而在异质性肿瘤中,它们保留在外部,并且存在更多不同类型的T细胞---一种抑制免疫反应的T细胞亚型。
Bartok说,“我们展示了两个极端---高度同质性肿瘤和高度异质性肿瘤---之间的差异,但大多数癌症介于这两者之间。为了系统地产生具有中等水平遗传异质性的肿瘤,我们构建出亲本异种系的系统发育树,并绘制出随时间推移不同的细胞亚型是如何出现的。然后,我们基于这种系统发育树构建出同质性细胞系的‘混合物’,在体外培养过程中或多或少地会出现异质性,并将它们注射到小鼠体内。”如预料的那样,细胞混合物形成的肿瘤具有更高的同质性,小鼠的免疫系统就更容易根除癌症,然而,所形成的肿瘤具有更高的异质性,它们就变得更具侵袭性。
Samuels说:“我们发现,测试细胞亚型的数量及其在系统发育树中的位置要比突变负担更好地预测免疫疗法是否取得成功。我们还分析了接受过免疫治疗的黑色素瘤患者的数据,发现这些因素与这种治疗的成功之间存在高度相关性。最终,我们打算使用我们构建的这种实验性系统来开发出适用于癌症患者的个性化治疗方案。”
3. Nat Commun:B细胞与黑色素瘤的免疫治疗有关
DOI: 10.1038/S41467-019-12160-2
欧洲分子生物学实验室(EMBL)欧洲生物信息学研究所和维也纳医科大学的研究人员发现,B细胞可能在黑色素瘤的免疫治疗中发挥重要作用。目前,免疫治疗主要集中在T细胞,但结果表明,B细胞也可以提供一个有趣的研究途径。
免疫疗法是利用人体自身的免疫系统来识别和对抗疾病的一种癌症治疗形式。它有多种形式,包括癌症疫苗、靶向抗体或肿瘤感染病毒。目前只有一些癌症患者从这种治疗中获益。
黑色素瘤是一种特别具有侵袭性的皮肤癌,目前的免疫疗法主要针对T细胞。T细胞在控制和塑造免疫系统方面发挥着重要的作用,它们能够直接杀死癌细胞,同时在这个过程中吸收其他细胞。
最近发表在《自然通讯》(Nature Communications)上的一项研究表明,B细胞与T细胞一样,在引发黑色素瘤相关炎症方面发挥着关键作用。B细胞是一种白细胞,它能产生抗体和几种重要的信使分子。研究人员发现,在黑色素瘤的病例中,B细胞几乎像一个卫星导航系统,通过分泌这种独特的信使分子将T细胞导向肿瘤。
"免疫疗法已经改变了癌症治疗,"维也纳医科大学和EMBL-EBI的研究人员Johannes Griss解释说。"它释放T细胞,使它们能以更有效的方式对抗癌症。我们第一次发现B细胞在这个过程中也起着重要的作用,帮助T细胞找到肿瘤。B细胞在免疫治疗中的作用目前还不清楚,但它们的作用可能比之前认为的更大"。
在研究过程中,研究人员发现,当黑色素瘤患者的B细胞减少时,肿瘤内的T细胞和其他免疫细胞的数量也显着减少。在随后的实验中,研究人员发现,一种特殊的B细胞亚型似乎负责引导T细胞和其他免疫细胞进入肿瘤。
有趣的是,黑色素瘤细胞似乎迫使B细胞发展成这种独特的B细胞亚型。最令人兴奋的是,这种特定的B细胞亚型也增加了目前免疫疗法对T细胞的激活作用,而且这种B细胞亚型在肿瘤治疗前的数量越多,预示着患者对后续免疫治疗的反应越好。
"需要进一步的研究来回答诸如黑色素瘤细胞如何改变B细胞,B细胞用什么机制来支持T细胞的激活,以及我们如何帮助这些B细胞支持目前癌症患者的免疫治疗等问题。"Griss总结道。
4. Cell:利用蛋白质组学技术揭示转移性黑色素瘤患者为何对免疫疗法没有反应?
DOI: 10.1016/j.cell.2019.08.012
近日,一项刊登在国际杂志Cell上的研究报告中,来自特拉维夫大学的研究人员通过研究解释了为何超过一半的转移性黑色素瘤患者对癌症免疫疗法没有反应,文章中,研究人员利用蛋白质组学技术(蛋白质图谱绘制)回答了目前他们迫切想要知道的一个问题,即为何免疫疗法对黑色素瘤患者有很大帮助,但对60%的转移性黑色素瘤患者却没有影响。
研究者对比了116名黑色素瘤患者对免疫疗法的反应(包括免疫疗法成功治疗和没有成功治疗的患者),运用蛋白质组学技术,研究者就能够发现两组患者机体中的癌细胞在代谢上的差异。研究者Markel教授说道,近些年来科学家们使用了多种癌症免疫疗法,即这些疗法能够增强机体免疫系统的抗癌活性,这些疗法能有效治疗部分癌症患者,但有些患者对免疫疗法却并没有反应,目前研究人员并不清楚其中的分子机制。
这项研究中,研究人员重点对转移性黑色素瘤进行研究,为了更好地理解癌细胞对疗法产生耐受性的分子机制,研究人员利用蛋白质组学技术分析了来自116名患者机体的肿瘤样本;研究者利用质谱仪对细胞中多种蛋白质进行图谱绘制,随后进行大量计算分析来识别两组患者机体中蛋白质的差异;蛋白质组的比较能帮助识别出对免疫疗法反应和无反应组患者机体的主要差异,在反应者机体中,高水平的蛋白表达与脂质代谢之间密切相关,其或许能被机体免疫系统更好地进行识别。
随后研究者在转移性黑色素瘤小鼠模型和黑色素瘤组织培养物中验证了他们的研究结果,利用遗传工程学技术,他们沉默了负责脂质代谢的细胞机制,研究者发现,沉默该代谢通路后,癌细胞就能够设法隐藏起来以免被宿主机体的T细胞识别并破坏,因此,小鼠机体的癌细胞要比对照组发育地更快。
这项研究中,研究者识别出了对疗法有反应和无反应两组患者机体中的主要差异,相关研究结果同样适用于研究其它恶性癌症;在随后的研究中,研究人员希望能够进行更为深入的研究找到新方法来改善癌症患者对免疫疗法的反应。
5. Cell Rep:阻断炎症通路是预防黑色素瘤脑转移的关键
DOI: 10.1016/j.celrep.2019.07.033
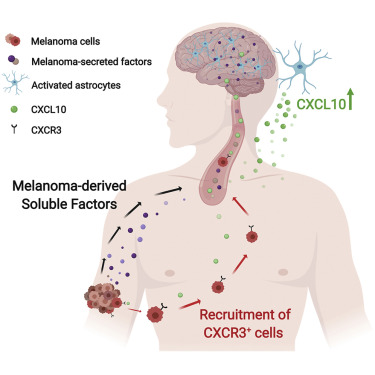
脑转移瘤是最致命的肿瘤转移之一,平均生存期不到一年,且脑转移的发生率正在上升。
特拉维夫大学(Tel Aviv University,TAU)的一项新研究发现,当肿瘤细胞"劫持"大脑中的炎症通路时,就会发生黑色素瘤脑转移。研究表明,阻断这一途径可以阻止这些转移的发生。
该研究的第一作者、TAU萨克勒医学院病理学系的Neta Erez教授解释说:"脑转移患者的预后非常糟糕。过去,在临床发现脑转移之前,病人往往死于其他地方的转移。随着治疗方法的改进和患者寿命的延长,确诊的脑转移的发生率也在增加。了解脑转移的发生方式和原因是当今癌症研究人员面临的紧迫挑战。"
这项研究于近日发表在《Cell Reports》上。这项研究由TAU的研究生Hila Doron博士和Malak Amer与TAU萨克勒医学院的Ronit Satchi-Fainaro教授合作进行。
这项新研究的重点是黑色素瘤的脑转移,因为"黑色素瘤是最致命的皮肤癌,因为它具有极高的转移率,经常转移到大脑," Erez教授说。
科学家利用小鼠自发黑色素瘤脑转移模型研究了黑色素瘤在脑微环境中的相互作用。他们发现黑素瘤的脑转移是由星形胶质细胞(星形胶质细胞在大脑中维持一种受保护的环境)接管一种生理炎症通路而促成的。此外,星形胶质细胞对大脑组织损伤的反应是通过激发炎症和组织修复反应来抑制损伤,分泌炎症因子来招募免疫细胞。
Erez教授说:"我们发现,肿瘤细胞会招募这些炎症因子,劫持它们进入大脑。我们发现了一种特定的因素,可以调节它们对大脑的吸引力,并表明大脑转移性黑色素瘤细胞表达了炎症因子的受体,这就是它们对这种信号的反应。"
值得注意的是,当研究人员使用基因工具来抑制黑色素瘤细胞上受体的表达时,他们成功地阻止了肿瘤细胞对星形细胞信号作出反应的能力,并显着抑制了脑转移瘤的发展。
研究人员在临床前小鼠模型中进行了初步研究后,科学家们在接受脑部手术的患者的脑转移中验证了他们的结果,发现星形胶质细胞表达与小鼠模型相同的炎症因子(CXCL10),肿瘤细胞表达与小鼠模型相同的受体(CXCR3)。这表明同样的机制在人类身上也起作用。
"我们的发现表明,阻断这一信号通路可能阻止脑转移," Erez教授总结道。"CXCL10-CXCR3轴可能是预防黑色素瘤脑转移的潜在治疗靶点。"
研究人员目前正在研究引发大脑炎症的诱因,而炎症会促进转移。
6. Science子刊:黑色素瘤治疗新希望!MDM2拮抗剂抵消这种癌症对CDK4/6抑制剂的抗性
doi:10.1126/scitranslmed.aav7171.
在一项新的研究中,来自美国退伍军人事务部和范德比尔特大学林格拉姆癌症中心研究人员确定了一种针对黑色素瘤患者的潜在二线治疗方案。相关研究结果发表在2019年8月14日的Science Translational Medicine期刊上,论文标题为“MDM2 antagonists overcome intrinsic resistance to CDK4/6 inhibition by inducing p21”。论文通讯作者为Anna Vilgelm博士。
这种潜在的治疗方案联合使用CDK4/6抑制剂与MDM2拮抗剂,从而使得这些抑制剂对黑色素瘤有效。CDK4/6抑制剂是一类用于治疗某些乳腺癌的药物,MDM2拮抗剂当前仍处于开发当中。通过使用黑色素瘤患者来源的肿瘤异体移植小鼠模型,Vilgelm及其同事们首次揭示了CDK4/6抗性出现的分子机制,然后测试了这种联合治疗是否会逆转这种抗性过程。他们报道了多种小鼠模型和人类肿瘤切片培养测定中的肿瘤消退。
论文共同作者Ann Richmond博士说,“40%以上的黑色素瘤表现出CDKN2A缺失或突变,CDKN2A是一个调节CDK4/6和MDM2来控制细胞周期的基因。”
尽管CDK4/6的激活是黑色素瘤产生的关键机制,但是CDK4/6抑制剂对黑色素瘤的效果不同于乳腺癌。Vilgelm及其同事们试图了解其中的原因。他们发现黑色素瘤细胞系中特定蛋白p21的缺乏是一个可能的原因。
MDM2拮抗剂可让肿瘤抑制蛋白p53保持稳定,并诱导p21表达,p21作为细胞周期进程的调节剂起作用并抵消对CDK4/6抑制剂的抗性。
Vilgelm说,“MDM2抑制剂需要功能性p53才能发挥作用。在许多类型的癌症中,p53会发生突变或缺失,这种肿瘤抑制蛋白的缺乏允许肿瘤进展。但是,在黑色素瘤中,p53的突变相对较少。因此,MDM2拮抗剂和CDK4/6抑制剂的联合使用是可能会让大部分的黑色素瘤患者受益。”
她说,因此,MDM2拮抗剂和CDK4/6抑制剂的联合使用可能仅对患有p53和RB野生型黑色素瘤的患者有益。
尽管近年来已有可用于黑色素瘤的疗法,特别是免疫疗法,但是近一半的黑色素瘤患者对免疫疗法没有反应。患者还经常对靶向治疗产生抗性,并且一旦抗性产生,就需要进行二线治疗。
Vilgelm说,“我认为这对于患有p53和RB野生型的对免疫疗法或其他的靶向治疗无反应或产生抗性的黑色素瘤患者来说是一种很好的潜在二线治疗方案。我认为这种联合使用在黑色素瘤的遗传学方面确实有意义。”
Richmond说,“我们发现将CDK4/6抑制剂与MDM2拮抗剂的联合使用能够克服黑色素瘤的这种遗传促进因素,即CDKN21的突变或丧失。这是非常有前景的,应当在临床试验中进一步进行测试。”
7. Nat Nanotechnol:纳米疫苗+消除MDSC增强黑色素瘤对免疫检查点抑制剂敏感性
doi.org/10.1038/s41565-019-0512-0

低应答率、获得性耐药和严重的副作用限制了免疫检查点治疗的临床效果。为了解决这些问题,近日来自以色列特拉维夫大学萨克勒医学院生理药理学系的Ronit Satchi-Fainaro教授和里斯本大学药学院药物研究所的Helena F. Florindo教授课题组合作,发现将癌症纳米疫苗和免疫抑制性微环境抑制剂联合使用,可以增强抗-PD-1抗体(αPD-1)和anti-OX40抗体(αOX40)治疗黑色素瘤的疗效,其中抗-PD-1抗体可以阻断免疫检查点PD-1的免疫抑制作用,抗OX40可以促进效应T细胞的刺激、扩张和生存。相关研究成果于近日发表在《Nature Nanotechnology》上,题为"Immunization with mannosylated nanovaccines and inhibition of the immune-suppressing microenvironment sensitizes melanoma to immune checkpoint modulators"。
研究人员发现,靶向树突状细胞的糖基化纳米疫苗与αPD-1 /αOX40结合的预防性和治疗性组合方案在治疗早期展现出了刺激T细胞浸润到肿瘤中的效果。然而,这种治疗方案的治疗和αPD-1 /αOX40相比,不会显着增强抑制肿瘤生长的效果,同时还会导致肿瘤内髓样来源抑制细胞浸润增加。
研究人员发现如果将这种疗法与骨髓来源的抑制细胞抑制剂ibrutinib联合使用,可以显着增强肿瘤消退和黑色素瘤小鼠的生存期延长。
因此,该研究表明靶向树突状细胞的糖基化纳米疫苗、ibrutinib和αPD-1 /αOX40之间的协同作用可以通过调节内源性免疫反应,增强免疫检查点调节因子对实体瘤的治疗疗效。
8. Sci Signal:黑色素瘤老是恶化?脂肪细胞或是罪魁祸首
DOI: 10.1126/scisignal.aav6847
由特拉维夫大学(TAU)人类遗传学和生物化学系的Carmit Levy教授和Tamar Golan博士领导的研究人员脂肪细胞参与黑色素瘤细胞的转化过程,这个过程中表皮中生长受限的癌细胞会转变为可以攻击病人其他重要器官的致命转移性细胞,相关研究成果于近日以封面文章的形式发表在《Science Signaling》上。
Levy教授解释说:"我们已经回答了一个困扰科学家多年的主要问题--是什么让黑色素瘤发生变化,变得具有攻击性和暴力性?锁在皮肤的外层(即表皮)的黑色素瘤是很容易治疗的;这只是是第1阶段,它还没有穿透真皮通过血管扩散到身体的其他部位,因此可以简单地移除,不会造成进一步的伤害。黑素瘤'醒过来'就会致命,癌细胞会转移到表皮下的真皮层,转移到重要器官。阻止黑色素瘤的转化是目前癌症研究的主要目标之一,我们现在知道脂肪细胞参与了这一变化。"
这项研究是与几位资深病理学家合作进行的,包括沃夫森医疗中心的Hanan Vaknin博士,特拉维夫医疗中心的Dov Hershkowitz博士和Valentina Zemer博士。
在这项研究中,研究人员检查了沃尔夫森医学中心和特拉维夫医学中心数十例黑色素瘤患者的活检样本,发现了一个可疑的现象:肿瘤部位附近存在脂肪细胞。
"我们问自己脂肪细胞在那里做什么,然后开始研究," Levy教授补充说道。"我们把脂肪细胞放在黑色素瘤细胞附近的培养皿中,观察它们之间的相互作用。"
研究人员观察到脂肪细胞将影响基因表达的细胞因子蛋白转移到黑色素瘤细胞。
"我们的实验表明,细胞因子的主要作用是降低一种名为miRNA211的基因的表达,这种基因抑制一种叫做TGF -beta的黑色素瘤受体的表达,TGF -beta是一种始终存在于皮肤中的蛋白质," Levy教授说。"肿瘤吸收高浓度的TGF beta,这种物质会刺激黑色素瘤细胞,使其具有侵袭性。"
至关重要的是,研究人员还找到了一种阻止这种转变的方法。
"值得注意的是,我们发现这个过程在实验室中是可逆的:当我们从黑色素瘤中移除脂肪细胞时,癌细胞就会平静下来,不再迁移," Levy教授补充道。
对小鼠黑色素瘤模型的实验也得出了类似的结果:当miRNA211被抑制时,在其他器官中也发现了转移,而重新表达该基因则阻止了转移的形成。
在基于这项新发现寻找潜在药物的过程中,研究人员对已知的抑制细胞因子和TGF beta的疗法进行了实验,但这些疗法以前从未用于治疗黑色素瘤。
Golan博士说:"我们正在讨论的这些物质,目前正在作为胰腺癌的可能治疗手段进行研究,同时也在进行前列腺癌、乳腺癌、卵巢癌和膀胱癌的临床试验。我们看到它们抑制了转移过程,黑色素瘤恢复到相对'平静'和休眠状态。"
Levy教授总结说:"我们的发现可以作为开发新药物的基础,以阻止黑色素瘤的扩散。这种疗法已经存在,但从未用于此目的。在未来,我们将寻求与制药公司合作,加强转移性黑色素瘤预防方法的开发。"
9. 一种古老的抗蠕虫药物氟苯达唑或能有效抑制黑色素瘤的生长和扩散

近日,来自澳大利亚新南威尔士大学的科学家们通过研究发现,一种使用了将近40年,用于治疗人类和动物蠕虫感染的药物或能用来抑制小鼠机体中黑色素瘤的生长和扩散,在欧洲这种药物是一种非处方药物,通常能用来抗蠕虫控制患者机体的寄生虫感染。
这种药物名为氟苯达唑(flubendazole),其能有效抑制小鼠机体中人类肿瘤的生长和转移,研究者Levon Khachigian教授表示,我们非常惊奇地发现,药物氟苯达唑的抗肿瘤效应主要包括其会抑制名为程序性细胞死亡蛋白-1(PD-1)的细胞表面蛋白的活性。当PD-1与名为PD-L1的蛋白相结合时,其就会帮助阻断免疫系统杀灭癌细胞;PD-1的抑制则会释放其对免疫系统功能的制动,从而促进免疫细胞寻找并破坏肿瘤。
这项研究中,研究人员在实验系统中将药物氟苯达唑与PD-1联系了起来,近年来随着免疫疗法的改进及PD-1抑制剂的引入,黑色素瘤的疗法发生了明显的改变;然而,当前临床可用的PD-1抑制剂是抗体,其需要患者进行静脉输入,一般每三周一次,但不幸的是,这种疗法也存在明显的挑战,很多患者并不会对当前的PD-1抑制剂产生反应,或这种反应并不能持久。
目前在临床上并没有一种小分子药物能够替代基于抗体的检查点抑制剂,不过有一些药物正在研发之中,其中就有一种药物正在临床试验中进行评估。研究者指出,在小鼠机体中,药物氟苯达唑就是一种新型的PD-1小分子抑制剂;研究者Khachigian表示,使用小分子PD-1抑制剂的患者可以作为门诊患者进行服用,这对于患者而言意味着更大的便利,同时也能避免静脉注射和节省化疗的成本。
最后研究者表示,尽管氟苯达唑是一种古老的药物,但其作为黑色素瘤疗法目前并未在人类机体中进行相关临床试验,而且目前氟苯达唑也并未批准用来治疗人类癌症,后期患者在服用该药物时应该寻求专业人士的意见。
10. Clin Cancer Res:新型药物组合或能有效抵御葡萄膜黑色素瘤
DOI:10.1158/1078-0432.CCR-18-3382
葡萄膜黑色素瘤(uveal melanoma)是一种影响眼睛的恶性黑色素瘤,这是一种非常罕见的疾病,每年在美国大约会有2500人被诊断患有这类黑色素瘤,而且大约有一半的葡萄膜黑色素瘤患者会发生癌症转移,癌细胞会侵袭到机体其它部位,主要是肝脏中;转移性葡萄膜黑色素瘤患者的预后较差,而且平均生存期也仅有17-20个月;近日,一项刊登在国际杂志Clinical Cancer Research上的研究报告中,来自美国墨菲特癌症中心等机构的科学家们通过进行临床研究鉴别出了一种能有效抵御转移性葡萄膜黑色素瘤的新型药物组合。
MAPK蛋白信号通路在皮肤和葡萄膜黑色素瘤中通常处于失调节状态,MEK蛋白主要参与了MAPK信号通路,而靶向MEK的药物或能明显改善黑色素瘤患者的预后;然而最近研究人员对葡萄膜黑色素瘤患者进行的一项III期临床试验结果表明,相比单独化疗治疗而言,利用MEK抑制剂联合化疗或许并不能改善患者的生存率。
很多葡萄膜黑色素瘤患者会对MEK抑制剂快速产生耐药性,这项研究中,研究人员通过研究想确定这种耐药性产生的分子机制,同时鉴别出特殊的药物来联合MEK抑制剂靶向作用葡萄膜黑色素瘤细胞使其破坏。研究者利用葡萄膜黑色素瘤细胞系进行实验,结果发现,MEK抑制剂能够阻断黑色素瘤细胞的生长,然而这种抑制作用的时间较短,而且最终癌细胞系还会产生一定的耐药性并继续生长,文章中,研究人员利用蛋白质组分析确定了在MEK抑制剂耐受期间到底哪些信号通路会被激活。
研究者Keiran Smalley博士指出,我们鉴别出了多种假设的逃逸通路,但MEK被抑制后期会处于上调状态,这些通路包括PI3K/AKT通路、ROR1/2和IGF-1R信号通路等,同时研究者还发现了能通过YAP蛋白促进MEK抑制剂耐药性的信号通路。目前并没有药物能够靶向作用AKT和YAP信号通路,研究人员对289种化合物进行筛选来寻找能限制从MEK逃逸的化合物,结果发现,对四种葡萄膜黑色素瘤细胞系影响最大的药物类型是组蛋白脱乙酰酶(HDAC)抑制剂,HDACs能够调节多种参与癌症发生的基因的表达水平,而且目前多种HDACs抑制剂获批用于治疗不同类型癌症;研究者发现,在所调查的这些HDACs抑制剂中,帕比司他(panobinostat)能够通过YAP和AKT来有效阻断耐药性的发生,同时还会增强葡萄膜黑色素瘤细胞系中MEK抑制剂的效应。此外,相比单一疗法而言,帕比司他与MEK抑制剂联合疗法或能有效抑制葡萄膜黑色素瘤细胞的生长。
最后研究者Smalley表示,我们希望临床前的研究发现能够帮助我们在葡萄膜黑色素瘤患者中启动相应的临床试验,临床批准的总HDCA抑制剂或能同时有效抑制黑色素瘤细胞中的AKT和YAP信号通路,这就表明,其或许能作为一种良好的候选靶点来帮助研究人员后期开展更深入的临床试验。(生物谷Bioon.com)
1. NEJM重磅消息:联合免疫治疗显著提高黑色素瘤患者长期生存率
DOI: 10.1056/NEJMoa1910836

根据皇家马斯登NHS基金会的一项研究,两种免疫治疗药物的组合--ipilimumab和nivolumab--已经在五年内或更长的时间里阻止或逆转了晚期黑色素瘤的进展。
就在10年前,只有1 / 20的晚期黑素瘤患者能存活5年,而许多患者只能存活6到9个月。Checkmate 067 trial的结果于近日在西班牙巴塞罗那举行的2019年ESMO年会上公布,并同时发表在《新英格兰医学杂志》(The New England Journal of Medicine)上,这是检查点抑制剂联合治疗的最长的3期随访临床实验。
皇家马斯登NHS基金会的肿瘤顾问、英国癌症研究所(ICR)的教授James Larkin介绍了研究结果,他说:"在过去,转移性黑色素瘤被认为是不可治愈的。肿瘤学家认为黑素瘤与其他癌症不同,一旦扩散就无法治疗。这是我们第一次可以说,晚期黑色素瘤长期幸存者的几率现在超过50%,这是一个巨大的里程碑。"
该试验将945名晚期黑色素瘤患者随机分为三组:314名患者接受了nivolumab和ipilimumab的"双重打击";316名患者接受了nivolumab+安慰剂治疗;315名患者接受ipilimumab +安慰剂治疗。每个nivolumab单独与ipilimumab进行比较,直到疾病进展或任何副作用变得不可接受为止。
nivolumab联合ipilimumab的5年总生存率为52%,其中74%的患者5年后无治疗。nivolumab的总生存率为44%,ipilimumab的总生存率为26%。
Larkin教授表示:"把这两种药物放在一起,你实际上是在给免疫系统踩下两个刹车,而不是一个。这样,免疫系统就能够识别它之前没有识别出的肿瘤,并做出反应,摧毁它们。"
重要的是,对于那些因为疲劳、皮疹和腹泻等副作用而停止治疗的患者,结果与那些长期服用联合用药的患者一样好。关于免疫疗法的一个关键点是,即使治疗时间很短,免疫系统也可以被重新教育。这与其他治疗如化疗形成对比,化疗需要一个完整的疗程才能达到同样的效果。
67岁的Pamela Smith在发现自己的黑色素瘤扩散后不久,于2014年1月参加了Checkmate 067临床试验。
Pamela说:"当时无法动手术,所以这次试验是我唯一的选择。我每两周接受一次治疗,持续了大约四个月,结果我得了严重的腹泻,不得不停止治疗。令人惊讶的是,第一次扫描和此后的每次扫描都表明,在相对较短的时间内,它成功了。我的肿瘤缩小到原来的一半不到,而且五年来没有变化。从那以后我再也没有接受过任何治疗,我感觉棒极了。"
2. Cell:黑色素瘤的异质性阻碍了有效的免疫反应
doi:10.1016/j.cell.2019.08.032.

在一项新的研究中,来自以色列魏茨曼科学研究所和美国国家癌症研究所等研究机构的研究人员发现在黑色素瘤中,如果肿瘤中的细胞能够分化为更加多样化的亚型,那么它就不太可能受到免疫系统的影响,这就降低了免疫疗法发挥疗效的机会。这些研究结果可能为设计针对癌症患者的个性化治疗方案提供了更好的工具,并且为研发抗癌疫苗指明了新的途径。相关研究结果近期发表在Cell期刊上,论文标题为“UVB-Induced Tumor Heterogeneity Diminishes Immune Response in Melanoma”。
尽管近年来由于采用了新的免疫疗法,黑色素瘤导致的癌症死亡人数有所下降,但是许多患者对这种疗法没有反应。基于此,论文共同通讯作者、魏茨曼科学研究所分子细胞生物学系的Yardena Samuels教授想要知道其中的原因。这种原因尚不清楚,不过一些研究支持的主要假设是具有更多突变的肿瘤---更高的“肿瘤突变负担(tumor mutational burden)”---更可能对免疫疗法作出反应。一些患者甚至花费大量资金进行放疗或化疗以增加肿瘤突变,但是这两者之间的因果关系尚未得到证实。Samuels和她的同事们对那些提出了一种不同的可能相关性---异质性(即肿瘤细胞之间的遗传多样性)和治疗反应之间的相关性---的研究很感兴趣。然而,若要研究这一理论,Samuels及其团队必须开发一种新的实验性系统,以准确地研究哪些因素起作用。
在这项研究中,在Samuels实验室的Yochai Wolf和Osnat Bartok的领导下,这些研究人员获取了小鼠黑色素瘤细胞,并将它们暴露于一种已知会促进这种癌症的紫外线下。这增加了肿瘤中的突变和细胞异质性。当他们给小鼠注射这些细胞或常规的黑色素瘤细胞时,受紫外线照射的黑色素瘤细胞增殖得更快,并且更具侵袭性。尽管这些细胞具有较高的突变负担,因而对免疫疗法作出更高的反应性,但实际上与原始肿瘤相比,它们被根除的可能性较小。换句话说,尽管具有较高的突变负担,但是异质性也很高,他们推测后者正在促进治疗抵抗性产生。
鉴于突变负担和异质性通常是并存的,这些研究人员需要找到一种方法来研究这两者之间的差异。他们从恶性肿瘤的培养物中提取出单个细胞,然后利用每个细胞生长出新的培养物。因此,他们最终获得了22种新的细胞培养物,每种细胞培养物具有较低的异质性但带有一定随机数量的突变。
当这些研究人员将这些细胞培养物注射到小鼠体内时,他们吃惊地发现,在突变负荷较高或较低的小鼠中,所有的肿瘤都生长缓慢,甚至在没有免疫疗法的情况下就消失了。为了确定小鼠的免疫系统是否确实负责杀死癌细胞,他们在免疫系统减弱的小鼠中重复了该实验。在这些小鼠中,癌症快速地扩散。
为了进一步了解这种免疫反应,这些研究人员再次尝试了该实验,它是在经过特定基因改造后缺乏T细胞的小鼠---已知抵抗癌症的免疫细胞---中进行的。Wolf说:“这些结果类似于在免疫系统减弱的小鼠中观察到的情形。当我们观察来自不同肿瘤的T细胞时,我们发现在同质性肿瘤(homogenous growths)中有更多的T细胞活性,而在异质性肿瘤中具有更少的T细胞活性。”实际上,这些研究人员发现,在同质性肿瘤中,T细胞已渗透到肿瘤的中心,而在异质性肿瘤中,它们保留在外部,并且存在更多不同类型的T细胞---一种抑制免疫反应的T细胞亚型。
Bartok说,“我们展示了两个极端---高度同质性肿瘤和高度异质性肿瘤---之间的差异,但大多数癌症介于这两者之间。为了系统地产生具有中等水平遗传异质性的肿瘤,我们构建出亲本异种系的系统发育树,并绘制出随时间推移不同的细胞亚型是如何出现的。然后,我们基于这种系统发育树构建出同质性细胞系的‘混合物’,在体外培养过程中或多或少地会出现异质性,并将它们注射到小鼠体内。”如预料的那样,细胞混合物形成的肿瘤具有更高的同质性,小鼠的免疫系统就更容易根除癌症,然而,所形成的肿瘤具有更高的异质性,它们就变得更具侵袭性。
Samuels说:“我们发现,测试细胞亚型的数量及其在系统发育树中的位置要比突变负担更好地预测免疫疗法是否取得成功。我们还分析了接受过免疫治疗的黑色素瘤患者的数据,发现这些因素与这种治疗的成功之间存在高度相关性。最终,我们打算使用我们构建的这种实验性系统来开发出适用于癌症患者的个性化治疗方案。”
3. Nat Commun:B细胞与黑色素瘤的免疫治疗有关
DOI: 10.1038/S41467-019-12160-2

欧洲分子生物学实验室(EMBL)欧洲生物信息学研究所和维也纳医科大学的研究人员发现,B细胞可能在黑色素瘤的免疫治疗中发挥重要作用。目前,免疫治疗主要集中在T细胞,但结果表明,B细胞也可以提供一个有趣的研究途径。
免疫疗法是利用人体自身的免疫系统来识别和对抗疾病的一种癌症治疗形式。它有多种形式,包括癌症疫苗、靶向抗体或肿瘤感染病毒。目前只有一些癌症患者从这种治疗中获益。
黑色素瘤是一种特别具有侵袭性的皮肤癌,目前的免疫疗法主要针对T细胞。T细胞在控制和塑造免疫系统方面发挥着重要的作用,它们能够直接杀死癌细胞,同时在这个过程中吸收其他细胞。
最近发表在《自然通讯》(Nature Communications)上的一项研究表明,B细胞与T细胞一样,在引发黑色素瘤相关炎症方面发挥着关键作用。B细胞是一种白细胞,它能产生抗体和几种重要的信使分子。研究人员发现,在黑色素瘤的病例中,B细胞几乎像一个卫星导航系统,通过分泌这种独特的信使分子将T细胞导向肿瘤。
"免疫疗法已经改变了癌症治疗,"维也纳医科大学和EMBL-EBI的研究人员Johannes Griss解释说。"它释放T细胞,使它们能以更有效的方式对抗癌症。我们第一次发现B细胞在这个过程中也起着重要的作用,帮助T细胞找到肿瘤。B细胞在免疫治疗中的作用目前还不清楚,但它们的作用可能比之前认为的更大"。
在研究过程中,研究人员发现,当黑色素瘤患者的B细胞减少时,肿瘤内的T细胞和其他免疫细胞的数量也显着减少。在随后的实验中,研究人员发现,一种特殊的B细胞亚型似乎负责引导T细胞和其他免疫细胞进入肿瘤。
有趣的是,黑色素瘤细胞似乎迫使B细胞发展成这种独特的B细胞亚型。最令人兴奋的是,这种特定的B细胞亚型也增加了目前免疫疗法对T细胞的激活作用,而且这种B细胞亚型在肿瘤治疗前的数量越多,预示着患者对后续免疫治疗的反应越好。
"需要进一步的研究来回答诸如黑色素瘤细胞如何改变B细胞,B细胞用什么机制来支持T细胞的激活,以及我们如何帮助这些B细胞支持目前癌症患者的免疫治疗等问题。"Griss总结道。
4. Cell:利用蛋白质组学技术揭示转移性黑色素瘤患者为何对免疫疗法没有反应?
DOI: 10.1016/j.cell.2019.08.012

近日,一项刊登在国际杂志Cell上的研究报告中,来自特拉维夫大学的研究人员通过研究解释了为何超过一半的转移性黑色素瘤患者对癌症免疫疗法没有反应,文章中,研究人员利用蛋白质组学技术(蛋白质图谱绘制)回答了目前他们迫切想要知道的一个问题,即为何免疫疗法对黑色素瘤患者有很大帮助,但对60%的转移性黑色素瘤患者却没有影响。
研究者对比了116名黑色素瘤患者对免疫疗法的反应(包括免疫疗法成功治疗和没有成功治疗的患者),运用蛋白质组学技术,研究者就能够发现两组患者机体中的癌细胞在代谢上的差异。研究者Markel教授说道,近些年来科学家们使用了多种癌症免疫疗法,即这些疗法能够增强机体免疫系统的抗癌活性,这些疗法能有效治疗部分癌症患者,但有些患者对免疫疗法却并没有反应,目前研究人员并不清楚其中的分子机制。
这项研究中,研究人员重点对转移性黑色素瘤进行研究,为了更好地理解癌细胞对疗法产生耐受性的分子机制,研究人员利用蛋白质组学技术分析了来自116名患者机体的肿瘤样本;研究者利用质谱仪对细胞中多种蛋白质进行图谱绘制,随后进行大量计算分析来识别两组患者机体中蛋白质的差异;蛋白质组的比较能帮助识别出对免疫疗法反应和无反应组患者机体的主要差异,在反应者机体中,高水平的蛋白表达与脂质代谢之间密切相关,其或许能被机体免疫系统更好地进行识别。
随后研究者在转移性黑色素瘤小鼠模型和黑色素瘤组织培养物中验证了他们的研究结果,利用遗传工程学技术,他们沉默了负责脂质代谢的细胞机制,研究者发现,沉默该代谢通路后,癌细胞就能够设法隐藏起来以免被宿主机体的T细胞识别并破坏,因此,小鼠机体的癌细胞要比对照组发育地更快。
这项研究中,研究者识别出了对疗法有反应和无反应两组患者机体中的主要差异,相关研究结果同样适用于研究其它恶性癌症;在随后的研究中,研究人员希望能够进行更为深入的研究找到新方法来改善癌症患者对免疫疗法的反应。
5. Cell Rep:阻断炎症通路是预防黑色素瘤脑转移的关键
DOI: 10.1016/j.celrep.2019.07.033

脑转移瘤是最致命的肿瘤转移之一,平均生存期不到一年,且脑转移的发生率正在上升。
特拉维夫大学(Tel Aviv University,TAU)的一项新研究发现,当肿瘤细胞"劫持"大脑中的炎症通路时,就会发生黑色素瘤脑转移。研究表明,阻断这一途径可以阻止这些转移的发生。
该研究的第一作者、TAU萨克勒医学院病理学系的Neta Erez教授解释说:"脑转移患者的预后非常糟糕。过去,在临床发现脑转移之前,病人往往死于其他地方的转移。随着治疗方法的改进和患者寿命的延长,确诊的脑转移的发生率也在增加。了解脑转移的发生方式和原因是当今癌症研究人员面临的紧迫挑战。"
这项研究于近日发表在《Cell Reports》上。这项研究由TAU的研究生Hila Doron博士和Malak Amer与TAU萨克勒医学院的Ronit Satchi-Fainaro教授合作进行。
这项新研究的重点是黑色素瘤的脑转移,因为"黑色素瘤是最致命的皮肤癌,因为它具有极高的转移率,经常转移到大脑," Erez教授说。
科学家利用小鼠自发黑色素瘤脑转移模型研究了黑色素瘤在脑微环境中的相互作用。他们发现黑素瘤的脑转移是由星形胶质细胞(星形胶质细胞在大脑中维持一种受保护的环境)接管一种生理炎症通路而促成的。此外,星形胶质细胞对大脑组织损伤的反应是通过激发炎症和组织修复反应来抑制损伤,分泌炎症因子来招募免疫细胞。
Erez教授说:"我们发现,肿瘤细胞会招募这些炎症因子,劫持它们进入大脑。我们发现了一种特定的因素,可以调节它们对大脑的吸引力,并表明大脑转移性黑色素瘤细胞表达了炎症因子的受体,这就是它们对这种信号的反应。"
值得注意的是,当研究人员使用基因工具来抑制黑色素瘤细胞上受体的表达时,他们成功地阻止了肿瘤细胞对星形细胞信号作出反应的能力,并显着抑制了脑转移瘤的发展。
研究人员在临床前小鼠模型中进行了初步研究后,科学家们在接受脑部手术的患者的脑转移中验证了他们的结果,发现星形胶质细胞表达与小鼠模型相同的炎症因子(CXCL10),肿瘤细胞表达与小鼠模型相同的受体(CXCR3)。这表明同样的机制在人类身上也起作用。
"我们的发现表明,阻断这一信号通路可能阻止脑转移," Erez教授总结道。"CXCL10-CXCR3轴可能是预防黑色素瘤脑转移的潜在治疗靶点。"
研究人员目前正在研究引发大脑炎症的诱因,而炎症会促进转移。
6. Science子刊:黑色素瘤治疗新希望!MDM2拮抗剂抵消这种癌症对CDK4/6抑制剂的抗性
doi:10.1126/scitranslmed.aav7171.

在一项新的研究中,来自美国退伍军人事务部和范德比尔特大学林格拉姆癌症中心研究人员确定了一种针对黑色素瘤患者的潜在二线治疗方案。相关研究结果发表在2019年8月14日的Science Translational Medicine期刊上,论文标题为“MDM2 antagonists overcome intrinsic resistance to CDK4/6 inhibition by inducing p21”。论文通讯作者为Anna Vilgelm博士。
这种潜在的治疗方案联合使用CDK4/6抑制剂与MDM2拮抗剂,从而使得这些抑制剂对黑色素瘤有效。CDK4/6抑制剂是一类用于治疗某些乳腺癌的药物,MDM2拮抗剂当前仍处于开发当中。通过使用黑色素瘤患者来源的肿瘤异体移植小鼠模型,Vilgelm及其同事们首次揭示了CDK4/6抗性出现的分子机制,然后测试了这种联合治疗是否会逆转这种抗性过程。他们报道了多种小鼠模型和人类肿瘤切片培养测定中的肿瘤消退。
论文共同作者Ann Richmond博士说,“40%以上的黑色素瘤表现出CDKN2A缺失或突变,CDKN2A是一个调节CDK4/6和MDM2来控制细胞周期的基因。”
尽管CDK4/6的激活是黑色素瘤产生的关键机制,但是CDK4/6抑制剂对黑色素瘤的效果不同于乳腺癌。Vilgelm及其同事们试图了解其中的原因。他们发现黑色素瘤细胞系中特定蛋白p21的缺乏是一个可能的原因。
MDM2拮抗剂可让肿瘤抑制蛋白p53保持稳定,并诱导p21表达,p21作为细胞周期进程的调节剂起作用并抵消对CDK4/6抑制剂的抗性。
Vilgelm说,“MDM2抑制剂需要功能性p53才能发挥作用。在许多类型的癌症中,p53会发生突变或缺失,这种肿瘤抑制蛋白的缺乏允许肿瘤进展。但是,在黑色素瘤中,p53的突变相对较少。因此,MDM2拮抗剂和CDK4/6抑制剂的联合使用是可能会让大部分的黑色素瘤患者受益。”
她说,因此,MDM2拮抗剂和CDK4/6抑制剂的联合使用可能仅对患有p53和RB野生型黑色素瘤的患者有益。
尽管近年来已有可用于黑色素瘤的疗法,特别是免疫疗法,但是近一半的黑色素瘤患者对免疫疗法没有反应。患者还经常对靶向治疗产生抗性,并且一旦抗性产生,就需要进行二线治疗。
Vilgelm说,“我认为这对于患有p53和RB野生型的对免疫疗法或其他的靶向治疗无反应或产生抗性的黑色素瘤患者来说是一种很好的潜在二线治疗方案。我认为这种联合使用在黑色素瘤的遗传学方面确实有意义。”
Richmond说,“我们发现将CDK4/6抑制剂与MDM2拮抗剂的联合使用能够克服黑色素瘤的这种遗传促进因素,即CDKN21的突变或丧失。这是非常有前景的,应当在临床试验中进一步进行测试。”
7. Nat Nanotechnol:纳米疫苗+消除MDSC增强黑色素瘤对免疫检查点抑制剂敏感性
doi.org/10.1038/s41565-019-0512-0

低应答率、获得性耐药和严重的副作用限制了免疫检查点治疗的临床效果。为了解决这些问题,近日来自以色列特拉维夫大学萨克勒医学院生理药理学系的Ronit Satchi-Fainaro教授和里斯本大学药学院药物研究所的Helena F. Florindo教授课题组合作,发现将癌症纳米疫苗和免疫抑制性微环境抑制剂联合使用,可以增强抗-PD-1抗体(αPD-1)和anti-OX40抗体(αOX40)治疗黑色素瘤的疗效,其中抗-PD-1抗体可以阻断免疫检查点PD-1的免疫抑制作用,抗OX40可以促进效应T细胞的刺激、扩张和生存。相关研究成果于近日发表在《Nature Nanotechnology》上,题为"Immunization with mannosylated nanovaccines and inhibition of the immune-suppressing microenvironment sensitizes melanoma to immune checkpoint modulators"。
研究人员发现,靶向树突状细胞的糖基化纳米疫苗与αPD-1 /αOX40结合的预防性和治疗性组合方案在治疗早期展现出了刺激T细胞浸润到肿瘤中的效果。然而,这种治疗方案的治疗和αPD-1 /αOX40相比,不会显着增强抑制肿瘤生长的效果,同时还会导致肿瘤内髓样来源抑制细胞浸润增加。
研究人员发现如果将这种疗法与骨髓来源的抑制细胞抑制剂ibrutinib联合使用,可以显着增强肿瘤消退和黑色素瘤小鼠的生存期延长。
因此,该研究表明靶向树突状细胞的糖基化纳米疫苗、ibrutinib和αPD-1 /αOX40之间的协同作用可以通过调节内源性免疫反应,增强免疫检查点调节因子对实体瘤的治疗疗效。
8. Sci Signal:黑色素瘤老是恶化?脂肪细胞或是罪魁祸首
DOI: 10.1126/scisignal.aav6847

由特拉维夫大学(TAU)人类遗传学和生物化学系的Carmit Levy教授和Tamar Golan博士领导的研究人员脂肪细胞参与黑色素瘤细胞的转化过程,这个过程中表皮中生长受限的癌细胞会转变为可以攻击病人其他重要器官的致命转移性细胞,相关研究成果于近日以封面文章的形式发表在《Science Signaling》上。
Levy教授解释说:"我们已经回答了一个困扰科学家多年的主要问题--是什么让黑色素瘤发生变化,变得具有攻击性和暴力性?锁在皮肤的外层(即表皮)的黑色素瘤是很容易治疗的;这只是是第1阶段,它还没有穿透真皮通过血管扩散到身体的其他部位,因此可以简单地移除,不会造成进一步的伤害。黑素瘤'醒过来'就会致命,癌细胞会转移到表皮下的真皮层,转移到重要器官。阻止黑色素瘤的转化是目前癌症研究的主要目标之一,我们现在知道脂肪细胞参与了这一变化。"
这项研究是与几位资深病理学家合作进行的,包括沃夫森医疗中心的Hanan Vaknin博士,特拉维夫医疗中心的Dov Hershkowitz博士和Valentina Zemer博士。
在这项研究中,研究人员检查了沃尔夫森医学中心和特拉维夫医学中心数十例黑色素瘤患者的活检样本,发现了一个可疑的现象:肿瘤部位附近存在脂肪细胞。
"我们问自己脂肪细胞在那里做什么,然后开始研究," Levy教授补充说道。"我们把脂肪细胞放在黑色素瘤细胞附近的培养皿中,观察它们之间的相互作用。"
研究人员观察到脂肪细胞将影响基因表达的细胞因子蛋白转移到黑色素瘤细胞。
"我们的实验表明,细胞因子的主要作用是降低一种名为miRNA211的基因的表达,这种基因抑制一种叫做TGF -beta的黑色素瘤受体的表达,TGF -beta是一种始终存在于皮肤中的蛋白质," Levy教授说。"肿瘤吸收高浓度的TGF beta,这种物质会刺激黑色素瘤细胞,使其具有侵袭性。"
至关重要的是,研究人员还找到了一种阻止这种转变的方法。
"值得注意的是,我们发现这个过程在实验室中是可逆的:当我们从黑色素瘤中移除脂肪细胞时,癌细胞就会平静下来,不再迁移," Levy教授补充道。
对小鼠黑色素瘤模型的实验也得出了类似的结果:当miRNA211被抑制时,在其他器官中也发现了转移,而重新表达该基因则阻止了转移的形成。
在基于这项新发现寻找潜在药物的过程中,研究人员对已知的抑制细胞因子和TGF beta的疗法进行了实验,但这些疗法以前从未用于治疗黑色素瘤。
Golan博士说:"我们正在讨论的这些物质,目前正在作为胰腺癌的可能治疗手段进行研究,同时也在进行前列腺癌、乳腺癌、卵巢癌和膀胱癌的临床试验。我们看到它们抑制了转移过程,黑色素瘤恢复到相对'平静'和休眠状态。"
Levy教授总结说:"我们的发现可以作为开发新药物的基础,以阻止黑色素瘤的扩散。这种疗法已经存在,但从未用于此目的。在未来,我们将寻求与制药公司合作,加强转移性黑色素瘤预防方法的开发。"
9. 一种古老的抗蠕虫药物氟苯达唑或能有效抑制黑色素瘤的生长和扩散

近日,来自澳大利亚新南威尔士大学的科学家们通过研究发现,一种使用了将近40年,用于治疗人类和动物蠕虫感染的药物或能用来抑制小鼠机体中黑色素瘤的生长和扩散,在欧洲这种药物是一种非处方药物,通常能用来抗蠕虫控制患者机体的寄生虫感染。
这种药物名为氟苯达唑(flubendazole),其能有效抑制小鼠机体中人类肿瘤的生长和转移,研究者Levon Khachigian教授表示,我们非常惊奇地发现,药物氟苯达唑的抗肿瘤效应主要包括其会抑制名为程序性细胞死亡蛋白-1(PD-1)的细胞表面蛋白的活性。当PD-1与名为PD-L1的蛋白相结合时,其就会帮助阻断免疫系统杀灭癌细胞;PD-1的抑制则会释放其对免疫系统功能的制动,从而促进免疫细胞寻找并破坏肿瘤。
这项研究中,研究人员在实验系统中将药物氟苯达唑与PD-1联系了起来,近年来随着免疫疗法的改进及PD-1抑制剂的引入,黑色素瘤的疗法发生了明显的改变;然而,当前临床可用的PD-1抑制剂是抗体,其需要患者进行静脉输入,一般每三周一次,但不幸的是,这种疗法也存在明显的挑战,很多患者并不会对当前的PD-1抑制剂产生反应,或这种反应并不能持久。
目前在临床上并没有一种小分子药物能够替代基于抗体的检查点抑制剂,不过有一些药物正在研发之中,其中就有一种药物正在临床试验中进行评估。研究者指出,在小鼠机体中,药物氟苯达唑就是一种新型的PD-1小分子抑制剂;研究者Khachigian表示,使用小分子PD-1抑制剂的患者可以作为门诊患者进行服用,这对于患者而言意味着更大的便利,同时也能避免静脉注射和节省化疗的成本。
最后研究者表示,尽管氟苯达唑是一种古老的药物,但其作为黑色素瘤疗法目前并未在人类机体中进行相关临床试验,而且目前氟苯达唑也并未批准用来治疗人类癌症,后期患者在服用该药物时应该寻求专业人士的意见。
10. Clin Cancer Res:新型药物组合或能有效抵御葡萄膜黑色素瘤
DOI:10.1158/1078-0432.CCR-18-3382

葡萄膜黑色素瘤(uveal melanoma)是一种影响眼睛的恶性黑色素瘤,这是一种非常罕见的疾病,每年在美国大约会有2500人被诊断患有这类黑色素瘤,而且大约有一半的葡萄膜黑色素瘤患者会发生癌症转移,癌细胞会侵袭到机体其它部位,主要是肝脏中;转移性葡萄膜黑色素瘤患者的预后较差,而且平均生存期也仅有17-20个月;近日,一项刊登在国际杂志Clinical Cancer Research上的研究报告中,来自美国墨菲特癌症中心等机构的科学家们通过进行临床研究鉴别出了一种能有效抵御转移性葡萄膜黑色素瘤的新型药物组合。
MAPK蛋白信号通路在皮肤和葡萄膜黑色素瘤中通常处于失调节状态,MEK蛋白主要参与了MAPK信号通路,而靶向MEK的药物或能明显改善黑色素瘤患者的预后;然而最近研究人员对葡萄膜黑色素瘤患者进行的一项III期临床试验结果表明,相比单独化疗治疗而言,利用MEK抑制剂联合化疗或许并不能改善患者的生存率。
很多葡萄膜黑色素瘤患者会对MEK抑制剂快速产生耐药性,这项研究中,研究人员通过研究想确定这种耐药性产生的分子机制,同时鉴别出特殊的药物来联合MEK抑制剂靶向作用葡萄膜黑色素瘤细胞使其破坏。研究者利用葡萄膜黑色素瘤细胞系进行实验,结果发现,MEK抑制剂能够阻断黑色素瘤细胞的生长,然而这种抑制作用的时间较短,而且最终癌细胞系还会产生一定的耐药性并继续生长,文章中,研究人员利用蛋白质组分析确定了在MEK抑制剂耐受期间到底哪些信号通路会被激活。
研究者Keiran Smalley博士指出,我们鉴别出了多种假设的逃逸通路,但MEK被抑制后期会处于上调状态,这些通路包括PI3K/AKT通路、ROR1/2和IGF-1R信号通路等,同时研究者还发现了能通过YAP蛋白促进MEK抑制剂耐药性的信号通路。目前并没有药物能够靶向作用AKT和YAP信号通路,研究人员对289种化合物进行筛选来寻找能限制从MEK逃逸的化合物,结果发现,对四种葡萄膜黑色素瘤细胞系影响最大的药物类型是组蛋白脱乙酰酶(HDAC)抑制剂,HDACs能够调节多种参与癌症发生的基因的表达水平,而且目前多种HDACs抑制剂获批用于治疗不同类型癌症;研究者发现,在所调查的这些HDACs抑制剂中,帕比司他(panobinostat)能够通过YAP和AKT来有效阻断耐药性的发生,同时还会增强葡萄膜黑色素瘤细胞系中MEK抑制剂的效应。此外,相比单一疗法而言,帕比司他与MEK抑制剂联合疗法或能有效抑制葡萄膜黑色素瘤细胞的生长。
最后研究者Smalley表示,我们希望临床前的研究发现能够帮助我们在葡萄膜黑色素瘤患者中启动相应的临床试验,临床批准的总HDCA抑制剂或能同时有效抑制黑色素瘤细胞中的AKT和YAP信号通路,这就表明,其或许能作为一种良好的候选靶点来帮助研究人员后期开展更深入的临床试验。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


