近期糖尿病领域研究进展一览
来源:本站原创 2019-09-23 00:04
2019年9月22日 讯/生物谷BIOON/ --本期为大家带来的是糖尿病领域的最新研究进展,希望读者朋友们能够喜欢。1. Science子刊:我国科学家揭示靶向YY1有望治疗糖尿病肾病doi:10.1126/scitranslmed.aaw2050.糖尿病肾病(diabetic nephropathy)是肾衰竭的主要原因,但缺乏对糖尿病肾病相关的纤维化和肾小球硬化的治疗方法。转化生长因子β1(T
2019年9月22日 讯/生物谷BIOON/ --本期为大家带来的是糖尿病领域的最新研究进展,希望读者朋友们能够喜欢。
1. Science子刊:我国科学家揭示靶向YY1有望治疗糖尿病肾病

doi:10.1126/scitranslmed.aaw2050.
糖尿病肾病(diabetic nephropathy)是肾衰竭的主要原因,但缺乏对糖尿病肾病相关的纤维化和肾小球硬化的治疗方法。
转化生长因子β1(TGFβ1,由基因TGFB1编码)已被确定为糖尿病肾病产生的主要致病因子。然而,当前的拮抗TGFβ1的策略未能在临床试验中表现出有益的治疗结果。
在一项新的研究中,来自中国上海交通大学和复旦大学等研究机构的研究人员为了鉴定出一种不同的治疗方法,设计出一种基于质谱的DNA-蛋白相互作用筛选方法,以便发现与TGFB1启动子结合的转录阻遏物。他们鉴定出一种称为阴阳1(Yin Yang 1, YY1)的蛋白分子是一种强效的TGFB1阻遏物。相关研究结果发表在2019年9月18日的Science Translational Medicine期刊上,论文标题为“Yin Yang 1 protein ameliorates diabetic nephropathy pathology through transcriptional repression of TGFβ1”
YY1直接与TGFB1启动子区域结合,并抑制人肾小球系膜细胞(renal mesangial cell)中TGFB1的转录。在小鼠模型中,肾小球系膜细胞中的YY1水平在早期的糖尿病肾脏病变期间升高了,而在后期的糖尿病肾脏病变期间发生下降。抑制肾脏中的YY1表达会加重肾小球硬化,而肾脏中的YY1过表达减弱了肾小球硬化。
此外,尽管YY1表达较高的患者和YY1表达较低的患者具有类似的糖尿病进展,但是相比于那些YY1表达较低的患者,YY1表达较高的患者更慢地患上糖尿病肾病。
这些研究人员发现一种称为桉脂素(eudesmin)的小分子通过增加人肾小球系膜细胞中的YY1表达来抑制TGFβ1和其他的促纤维化因子,并且通过增加YY1表达来减轻糖尿病肾病小鼠模型中的糖尿病肾脏病变。
这些结果表明在糖尿病小鼠患上糖尿病肾病的过程中,YY1是一种强效的TGFB1转录阻遏物,靶向YY1的小分子可能成为一种有前途的治疗糖尿病肾病的方法。
2. Diabetologia:科学家们发现I型糖尿病的新型生物标志物

DOI: 10.1007/s00125-019-04980-0
近日,来自芬兰图尔库生物科学中心的研究人员发现,血液中存在一种指征1型糖尿病的新生物标志物。新发现可能有助于了解该疾病的早期发病机理。
在15岁以下的儿童群体中,芬兰的1型糖尿病发病率最高。此外,在许多发达国家中,儿童群体的该疾病患病率也正在不断提高。
使用最新的代谢组学方法,图尔库生物科学中心的研究人员发现了胰岛自身抗体出现之前血液中代谢物的变化。这些发现可能对寻找1型糖尿病的早期标志物和了解疾病的发病机理具有重要意义。
在当前的临床实践中,胰岛自身抗体是第一个可以被检测到的发病信号。但是,对于预防糖尿病的发生与发展来说,自身抗体能够被检测到时可能已经太迟了。
“因此,我们目前的发现表明,对1型糖尿病的早期预测是可行的,从而为疾病预防干预措施提供了新的机会,”图尔库生物科学中心的负责人说到。
该研究小组正在与赫尔辛基大学的Mikael Knip教授合作,在更加广大的人群中验证他们当前和以前的发现。 “我们的未来目标是通过增进对代谢和免疫系统相互作用的了解,提供对1型糖尿病疾病发病机理的新见解,这将是早期预测和预防该疾病的重要基石”。
3. Genome Research:基因治疗可以减少肥胖,逆转小鼠的2型糖尿病


DOI:10.1101/gr.246900.118
全球近5亿人受到肥胖的影响,其中很多是儿童。与肥胖相关的疾病,包括心脏病、中风、2型糖尿病和癌症,是可预防死亡的主要原因。肥胖是由遗传因素和环境因素共同造成的,影响了有效的抗肥胖药物的开发,这些药物存在严重的脱靶效应。在近日发表在《Genome Research》杂志上的一项研究中,研究人员开发了一种基因疗法,可以专门降低肥胖小鼠的脂肪组织,逆转与肥胖相关的代谢疾病。
为了克服目前抗肥胖药物的副作用,研究人员Jee Young Chung和同事开发了一种针对脂肪酸代谢基因Fabp4的特殊基因沉默疗法。研究人员使用了CRISPR干扰系统,其中催化死亡的Cas9蛋白和单导RNA与组织特异性融合肽靶向白色脂肪细胞。复合物内化后对细胞毒性小,内化后,分子复合物降低Fabp4的表达,减少脂肪细胞内脂质储存。为了证明这种传递方法在细胞中表现良好,Chung和他的同事在肥胖小鼠身上测试了他们的治疗方法。给老鼠喂食高脂肪食物会导致肥胖和胰岛素抵抗。Fabp4的抑制作用使患者的体重减轻了20%,并在仅仅6周的治疗后改善了胰岛素抵抗和炎症。研究人员同时还观察到其他的全身改善,包括减少脂肪脂肪沉积在肝脏和减少循环甘油三酯。
目前FDA批准的标准治疗显示,在人类接受治疗一年后,体重仅下降了5%。然而,尽管这种疗法在小鼠身上显示出良好的效果,但在用于临床治疗人类疾病之前还需要进一步的研究。重要的是,这项工作突出了精确基因编辑技术的进步,这可以转化为其他类型的治疗。
4. TEM:靶向作用细胞“自噬”有望抑制肥胖和2型糖尿病等多种代谢性疾病的发生

doi.org/10.1016/j.tem.2019.07.009
我们是否能通过改变细胞清理垃圾的方式来治疗肥胖或2型糖尿病呢?这就好比一个家庭如果被垃圾填满就无法运转一样,一个细胞如果不丢弃所产生的垃圾就会变得不再健康,然而细胞可以讲这些垃圾进行分解来制造能量,这一过程就称之为自噬过程。
近日,一项刊登在国际杂志Trends in Endocrinology and Metabolism上的研究报告中,来自佛罗里达大学的科学家们通过研究调查了细胞自噬在诸如肥胖和2型糖尿病等代谢性疾病中所扮演的关键角色。研究者Zhiyong Cheng教授说道,自噬是细胞进行质量控制的一种特殊方式,如果无法进行有效的自噬过程,细胞就无法自我更新,从另一方面来讲,如果自噬过多,其也会破坏细胞自身组分的平衡,进而诱发细胞死亡,因此适度调节的自噬过程对于维持机体健康至关重要。
过多或过少的自噬过程往往与机体多种代谢性疾病的发生直接相关,比如肥胖、2型糖尿病和糖尿病合并症等,研究者Cheng说道,如果我们能找到引发异常自噬过程的罪魁祸首,或许就能以其作为靶点来开发治疗多种疾病的新型疗法,这是我们实验室长期以来进行的研究项目。此前研究者Cheng发表综述阐述了研究人员对调节细胞自噬的多种蛋白的研究成果,这些蛋白称之为FoxO蛋白,研究者希望能以其作为关键点来开发抑制与肥胖和2型糖尿病发病相关的机体健康负面效应。
研究者表示,这项研究中我们鉴别出了FoxO1蛋白,其是FoxO蛋白家族的成员之一,FoxO1能通过自噬过程作为脂肪组织形成的调节子,当研究者阻断FoxO1时就会抑制白色储存能量的脂肪产生,同时还会增加棕色燃烧能量的脂肪产生,由于肥胖源于白色脂肪的扩张和过度形成,因此靶向作用FoxO1或许就有望抑制肥胖发生。此外研究人员还阐述了调查FoxO-细胞自噬关系之间的三种主要方法。其中一种方法就是观察FoxO与DNA之间的相互作用,这种相互作用称之为转录,FoxO与DNA结合以便细胞能够开启自噬过程,另一种方法则分析了细胞中依赖于DNA的FoxO的功能;最后一种就是表观遗传学方法,其能够调查诸如营养物质和压力等环境因素如何影响FoxO的形成,这种方法让研究者Cheng非常激动。
研究者Cheng表示,我们最感兴趣的就是在表观遗传学方面来阐述FoxO和细胞自噬之间的关联,因为这一领域尚处于萌芽期,因此未来未知的东西很多;此外,通过生活方式的修饰或干预就能有效逆转环境诱导的FoxO表观遗传学效应和细胞的自噬过程,本文研究的目的在于发现可靠的表观遗传学因素,其或能促进疾病的早期诊断并帮助开发新型干预措施来预防多种代谢性疾病的发生。
5. FASEB J & Endocrinology:科学家阐明生物钟与肥胖及糖尿病之间的神秘关联


DOI:10.1210/en.2018-00935.
DOI:10.1096/fj.201901004R
在一天中的特定时间不吃饭是否会降低个体患肥胖或糖尿病的风险?外面的路灯会让你变胖吗?近日,一项刊登在国际杂志The FASEB Journal上的研究报告中,来自奥塔哥大学的科学家们通过研究阐明了糖尿病、肥胖与机体昼夜节律钟(生物钟)之间的关联。
文章中,研究人员在实验室可控条件下分析了生物钟的干扰对小鼠的影响效应,他们发现,反复的时差反应会导致小鼠体重增加并出现严重的糖尿病症状;研究者需要思考到底是什么干扰了生物钟,任何干扰生物钟的因素都会影响人类机体健康,比如旅行时差、社交时差、倒班工作、在错误的时间暴露于强光下等等。
研究者Alexander Tups教授说道,非常明亮的街灯会干扰机体褪黑激素的分泌,褪黑激素是一种调节机体昼夜节律钟的激素,干扰褪黑激素的生成会引发人类肥胖和糖尿病发生,而且如今越来越多的研究证据也表明,干扰褪黑激素也会引发癌症。研究者希望本文研究结果能够加速人类相关的研究,调查人工光的强度是否会抑制机体褪黑激素的分泌,从而影响人类机体健康。此外,研究者还进行了另一项研究阐明生物钟如何影响机体加工含脂肪的食物。
研究者表示,从本质上来讲,重要的是我们什么时候吃饭,机体会产生哪种激素来抵御一天中特定时间点所摄入的高脂肪食物,如果我们在这些激素不发挥作用的时候避免进食的话,我们就能够减少脂肪饮食对机体的有害影响。与进食时间相关的重要激素就是瘦素,其是一种体重调节激素,在一天中机体瘦素耐受期时,高脂肪饮食对机体的有害影响会加剧。与传统想法相反的是,对瘦素耐受在肥胖小鼠机体中或许并不普遍。
Tups指出,有时候小鼠对这种激素依然敏感,因此如果其饮食模式被限制在这段时间内,有益的影响就能够最大化。在小鼠机体中,当摄入的高脂肪饮食被限制在深夜和凌晨时(即动物机体对瘦素耐受的时候),这对小鼠机体的新陈代谢尤为有害,对小鼠而言,这将是晚餐时间,因为它们在晚上活动,白天则处于睡眠状态;基于这种差异,目前研究人员并不确定到底我们不吃哪一顿才能够有效减轻体重。
最后研究者表示,如果本文研究结果能够转化到人类中的话,那么很有可能是晚餐,其与机体的生物钟会保持一致,当然这也取决于个体的时间类型,也就意味着一个人到底是百灵鸟还是猫头鹰,其在选择不吃哪一顿时就会产生明显不同的效应。
6. Diabetologia:研究发现一群叛变的T细胞亚群,竟然与1型糖尿病有关
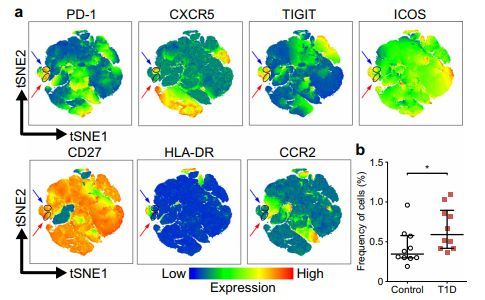

DOI:10.1007/s00125-019-4936-8
东芬兰大学(University of Eastern Finland)的一项研究表明,最近发现的一种T细胞亚群,即所谓的外围辅助性T细胞,可能在1型糖尿病的发展中发挥了作用。最近诊断为1型糖尿病的儿童和后来发展为1型糖尿病的健康儿童的外周血T辅助细胞循环频率均有所增加。这项研究发表在《Diabetologia》杂志上。
1型糖尿病是一种典型的儿童自身免疫性疾病。在1型糖尿病中,胰腺中产生胰岛素的细胞被免疫系统破坏。除了遗传易感性外,血液中自身抗体的出现也预示着1型糖尿病的未来发展。
临床糖尿病前自身抗体的出现是由于胰岛中B细胞对蛋白质的活化引起的。淋巴组织中B细胞的活化反过来又由滤泡辅助T细胞控制。早前,研究院研究员Tuure Kinnunen和他在东芬兰大学的研究小组的工作表明,在接近1型糖尿病发病的儿童中,滤泡辅助T细胞的频率增加。
最近,一种新的T细胞亚群被认为具有类似的激活B细胞的能力。这些所谓的外周辅助T细胞类似滤泡辅助T细胞,但它们表达受体,使它们能够迁移到发炎的组织。
目前的研究表明,外周辅助T细胞在1型糖尿病的发展中起着重要作用。研究人员证明,无论是新近诊断为1型糖尿病的儿童,还是健康且自身抗体呈阳性的儿童,血液中这些细胞的频率都有所增加。重要的是,这种频率在那些后来发展成1型糖尿病的自身抗体阳性儿童中明显增加。
"根据我们的研究结果,外围辅助性T细胞可能在1型糖尿病的发展中发挥作用。这一信息可用于开发更好的方法来预测1型糖尿病的风险和新的免疫疗法。然而,还需要进行更多的研究来验证我们的结果,并进一步确定周围辅助T细胞的功能。
这项研究是利用芬兰DIPP研究的样本进行的,在该研究中,从出生起就跟踪具有该疾病遗传风险的儿童患1型糖尿病的情况。这项研究包括来自图尔库大学、赫尔辛基大学、奥卢大学以及哈佛大学的研究人员。
7. Cell Metab:糖尿病药物依帕列净也有望治疗心脏病

doi:10.1016/j.cmet.2019.08.015.
在一项新的研究中,来自加拿大多伦多圣-迈克尔医院、西安大略大学和罗巴茨研究院等研究机构的研究人员揭示了一类有助于调节2型糖尿病患者体内血糖的药物如何也可以预防心脏病。这一结果来自于EMPA-HEART CardioLink-6临床试验,重点关注糖尿病药物---依帕列净(empagliflozin)---对血管中细胞修复的影响以及由此导致的心脏病风险。依帕列净属于一类称为SGLT2抑制剂的药物,可降低血糖。相关研究结果近期发表在Cell Metabolism期刊上,论文标题为“SGLT2 Inhibition with Empagliflozin Increases Circulating Provascular Progenitor Cells in People with Type 2 Diabetes Mellitus”。
这项研究表明循环祖细胞---它们是在骨髓中发现的并在心脏健康中发挥作用---与炎性细胞一起受到这种糖尿病药物的调节。对于患有糖尿病并且有患心脏病风险的患者,这类药物可以通过减轻受损的细胞来提供心脏保护,否则这些细胞会因血管修复不当而使得心脏病长期存在。
论文通讯作者、圣-迈克尔医院基兰生物医学科学研究中心心脏外科医生Subodh Verma博士说,“我们已看到大规模的临床试验为我们提供了明确的证据,即SGLT2抑制剂还可以保护糖尿病患者免受心脏病。在我们的这项研究之前,人们不知道为何会发生这种情况。”
根据世界卫生组织(WHO)的数据,2016年大约有160万人死于糖尿病。它是失明、肾衰竭、心脏病发作、中风和下肢截肢的主要原因。心脏病是糖尿病患者的主要关注点,这是因为他们的血管修复经常受到破坏,这就使得他们更容易患上心血管疾病。
通过使用来自EMPA-HEART CardioLink-6临床试验的血液样本,西安大略大学舒立克医学与牙科学院副教授、罗巴茨研究院研究员David Hess博士能够证实在糖尿病中,再生性的祖细胞减少了。然而,在服用依帕列净的患者中,这些祖细胞得到恢复。
Hess博士说,“我们发现,在服用依帕列净的糖尿病患者中,不仅有益的祖细胞增加了,而且我们观察到炎症和氧化应激减少的迹象,其中炎症和氧化应激也可能导致心血管疾病。”Verma博士说,对于糖尿病患者来说,这是降低患心脏病风险的重要一步。
这些研究人员表示,这些新发现可能为开发针对心脏病合并糖尿病患者的新疗法奠定了基础。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


