这些关于人类健康的肠道微生物NCS重磅研究千万别看...
来源:本站原创 2019-08-30 06:30
2019年8月30日讯 /生物谷BIOON /——最近几年关于肠道微生物的研究越来越火热,日益深入的研究也逐渐揭开了肠道微生物的诸多秘密,越来越多的研究发现肠道微生物与人类健康密切相关。本文中小编为大家盘点了近期关于肠道微生物与健康相关的NCS重磅研究,分享给大家。【1】Cell:震惊!肿瘤微生物组竟能决定癌症患者的生死DOI:10.1016/j.cell.2019.07.008.在一项新的研究中
2019年8月30日讯 /生物谷BIOON /——最近几年关于肠道微生物的研究越来越火热,日益深入的研究也逐渐揭开了肠道微生物的诸多秘密,越来越多的研究发现肠道微生物与人类健康密切相关。本文中小编为大家盘点了近期关于肠道微生物与健康相关的NCS重磅研究,分享给大家。
在一项新的研究中,来自美国德克萨斯大学MD安德森癌症研究中心的研究人员发现少数长期存活的胰腺癌患者与许多对所有治疗方案都无效的胰腺癌患者之间的一个关键区别在于他们的肿瘤中的细菌群落刺激或抑制免疫反应。相关研究结果发表在2019年8月8日的Cell期刊上。
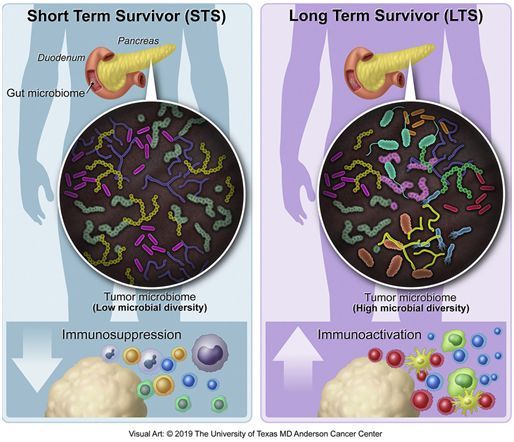
这些研究人员通过使用16S rRNA基因测序,发现长期存活者的细菌种类多样性远远超过短期存活者。仅通过这种多样性测量对来自MD Anderson队列的患者进行分类表明具有高度多样性的患者的中位生存期为9.66岁,而多样性较低的患者的中位生存期为1.66年。这种多样性结果与诸如之前采用的疗法、身体质量指数(BMI)和抗生素使用之类的其他因素无关,这就使得它成为患者存活的预测因子,并指出肿瘤微生物组在癌症进展中的潜在重要性。
免疫组织化学显示这两个队列中长期存活者的肿瘤具有更大的T细胞密度,包括CD8阳性杀伤性T细胞,这就与之前的研究结果---长期存活者具有更强的免疫反应---相一致。研究人员比较了三名手术患者的肠道、肿瘤和邻近组织中的细菌。他们发现肠道微生物组大约占肿瘤微生物组的25%,但在正常的邻近组织中不存在,这表明肠道中的细菌能够能在胰腺瘤中定植。这些研究人员将晚期癌症患者的粪便菌群移植到小鼠体内,发现供者微生物组大约占由此产生的肿瘤微生物组的5%,但是整个肿瘤微生物组的70%已被移植的粪便菌群改变。
接下来,他们将来自晚期胰腺癌患者、存活超过5年且无疾病迹象的患者和健康对照者的粪便菌群移植到小鼠体内。在肿瘤产生五周后,接受来自晚期胰腺癌患者的粪便菌群移植的小鼠具有更大的肿瘤,而接受来自长期存活者的粪便菌群移植的小鼠体内的肿瘤的平均大小减少了70%,接受来自健康对照者的粪便菌群移植的小鼠体内的肿瘤的平均大小减少了50%。免疫分析显示与其他两组相比,接受来自长期存活者的粪便菌群移植的小鼠具有显着更高的CD8阳性T细胞数量和更大的CD8阳性T细胞活化。接受来自晚期胰腺癌患者的粪便菌群移植的小鼠具有增加的调节性T细胞和髓源性抑制细胞,这两种细胞都抑制免疫反应。为了评估FMT的作用是否依赖于免疫系统,这些研究人员剔除了一组接受来自长期存活者的粪便菌群移植的小鼠中的T细胞,这完全阻断了FMT的抗肿瘤作用。
魏茨曼科学研究所的研究人员在老鼠身上进行的研究发现,肠道微生物(统称肠道微生物群)可能会影响肌萎缩侧索硬化症(ALS)的进程,也被称为卢伽雷氏症。研究人员发现,小鼠接受了某些肠道微生物株或已知由这些微生物分泌的物质后,一种类似ALS的疾病的进展变慢,初步结果表明,该菌群调节功能的发现可能适用于ALS患者,相关研究成果于近日发表在《Nature》上。
科学家们在一系列实验中证明,在转基因小鼠中使用广谱抗生素清除其大部分微生物群后,一种类似ALS的疾病的症状会恶化。此外,科学家们还发现,在无菌条件下培育这些易患ALS的小鼠非常困难,因为这些小鼠很难在无菌环境中生存。综上所述,这些结果暗示了微生物群的改变与遗传上易患ALS的小鼠疾病加速发展之间的潜在联系。
接下来,利用先进的计算方法,科学家们对易患ALS的小鼠体内微生物组的组成和功能进行了表征,并将它们与正常小鼠进行了比较。他们鉴定出11种微生物菌株,这些菌株在易患ALS的小鼠中随着疾病的进展而发生变化,甚至在小鼠出现明显的ALS症状之前就发生了变化。当科学家们分离出这些微生物菌株,并在抗生素治疗后以类似益生菌的补充物的形式,一个接一个地给易患ALS的小鼠服用时,其中一些菌株对这种类似ALS的疾病产生了明显的负面影响。但有一种叫Akkermansia muciniphila的菌株显着减缓了小鼠的疾病进展,延长了它们的存活时间。
为了揭示该细菌产生这种效果的机理,科学家们检测了肠道微生物分泌的数千个小分子。他们将注意力集中在一种叫做烟酰胺(NAM)的分子上:抗生素治疗后,易患ALS的小鼠血液和脑脊液中的烟酰胺水平降低,而在补充了能够分泌这种分子的Akkermansia后,烟酰胺水平升高。为了证实NAM确实是一种能够阻碍ALS进程的微生物分泌分子,科学家们不断地向易患ALS的小鼠体内注入NAM。这些小鼠的临床状况明显改善。对他们大脑中基因表达的详细研究表明,NAM能改善他们运动神经元的功能。
来自美国华盛顿大学圣路易斯医学院和孟加拉国腹泻疾病研究国际中心等研究机构的一个跨学科研究团队采取了一种新方法来解决儿童营养不良这一紧迫的全球健康问题。他们的方法着重关注于通过使用负担得起的文化上可接受的食物中存在的成分选择性地促进关键的促生长的肠道微生物的健康发育。他们的研究支持这样一种观念,即婴儿和儿童的健康成长与他们出生后的肠道微生物群落的健康发育密不可分。相关研究结果发表在2019年7月12日的Science期刊上的两篇论文中
由华盛顿大学和孟加拉国腹泻疾病研究国际中心开发的这些新的肠道微生物组导向的治疗性食品来自他们早前对孟加拉国健康儿童肠道微生物群落发育的研究。几年前,他们发现营养不良的儿童具有未成熟的肠道微生物群落---这些肠道微生物群落看起来要比年龄相匹配的健康同龄人中的更年轻。Ahmed指出,几年前他们发现常规的治疗性食品未能修复他们治疗过的营养不良儿童中的这种不成熟现象。
Gordon团队接着将来自营养不良儿童的未成熟肠道微生物群落以及来自健康儿童的通常发育成熟的肠道微生物群落移植到通常在无菌条件下饲养的小鼠中。结果表明未成熟的肠道微生物群落与小鼠受者的体重增加减少、骨骼发育缺陷以及代谢和免疫功能异常有关。这些发现提供了早期证据表明未能形成正常的肠道微生物群落可能是营养不良的原因,而不是营养不良的后果。
在这两篇论文的第一篇中,论文共同第一作者Jeanette L. Gehrig博士、Siddarth Venkatesh博士和Hao-Wei Chang(他们都是Gordon实验室的成员)描述了他们如何首次使用无菌小鼠,然后是无菌小猪,并且将来自孟加拉国儿童的肠道微生物群落成员移植到这些无菌小鼠和无菌小猪中,以便筛选由孟加拉国使用的辅助食品成分组成的一系列饮食。他们制定了肠道微生物组导向的辅助食品原型(Microbiome-Directed Complementary Food prototype),这种食品原型能够修复移植这两种动物模型中的源自营养不良孟加拉国儿童的未成熟肠道微生物群落,并改善这些动物的健康状况。然后,这些研究人员依照上面描述的双盲控制喂养研究对这种食品原型进行测试。
在第二篇论文中,论文第一作者、Gordon实验室成员Arjun S. Raman博士描述了基于最初由经济物理学领域开发的用于分析经济波动如何影响复杂动态的金融市场的方法,并开发新的计算方法。这种方法提供了新的通用方法来表征人肠道微生物群落的结构----它们的正常发育,它们在营养不良等疾病状态中如何受到干扰,以及它们如何对旨在修复它们的治疗干预措施作出反应。
在最近一项的=研究中,加州大学旧金山分校的研究人员描述了微生物组如何干扰药物预期作用的第一个具体例子。他们专注于左旋多巴(L-dopa),这是帕金森病的主要治疗药物,他们确定了数万亿种细菌中的哪些细菌负责降解药物以及如何阻止这种微生物干扰现象的发生。
使用人类微生物组项目作为参考,Maini Rekdal和他的团队通过细菌DNA寻找哪些肠道微生物具有编码类似酶的基因。有几种微生物符合他们的标准,其中只有一种粪肠球菌(粪肠球菌),能够代谢掉所有左旋多巴。通过这一发现,该团队提供了第一个将粪肠球菌和细菌酶(PLP依赖性酪氨酸脱羧酶或TyrDC)与L-多巴代谢相关联的有力证据。
即使人类和细菌酶发挥完全相同的化学反应,细菌也看起来有点不同。Maini Rekdal推测卡比多巴可能无法穿透微生物细胞,或者轻微的结构差异可能阻止药物与细菌酶相互作用。 但原因可能无关紧要。Balskus和她的团队已经发现了一种能够抑制细菌酶的分子。"该分子关闭了这种不必要的细菌代谢而不会杀死细菌",Maini Rekdal说。这种和类似的化合物可以为开发新药物提供起点,以改善帕金森病患者的左旋多巴治疗效果。
【5】一篇Nature和一篇Nature Medicine指出人体微生物组与前驱糖尿病、炎症性肠病和早产密切相关
2008年,美国国家卫生研究院(NIH)资助了人类微生物组计划(Human Microbiome Project, HMP)---一个雄心勃勃的项目,类似于人类基因组计划,旨在描述生活在我们每个人身上的极其复杂的微生物。六年后,该计划扩展为综合性人类微生物组计划(integrative Human Microbiome Project, iHMP),目的是了解身体不同部位的微生物组如何随着时间的推移以及在各种健康状况(如妊娠或疾病)中发生的变化。如今,两项新的研究---一项发表在Nature期刊上,还有一项发表发表在Nature Medicine期刊上---将微生物组组成与2型糖尿病、妊娠和炎症性肠病(IBD)关联在一起。每项研究包括来自数千份血液样本、活组织样本和微生物拭子样本的数据,这些样本都是长期反复从患者身上采集的。
图片来源:Nature
在第一项研究中,研究人员发现患有前驱糖尿病或存在功能失调的胰岛素受体信号转导的患者对呼吸道病毒感染的反应受到破坏和发生延迟,他们认为这可能导致延长的低水平炎症,已知这会加重糖尿病等疾病。与具有健康的胰岛素受体信号转导的患者相比,来自胰岛素受体信号转导存在功能障碍的患者的鼻腔和肠道微生物组在对这种感染作出的反应中发生不同的变化。
第二项研究没有跟踪疾病,而是跟踪与怀孕有关的微生物多样性的变化---特别是那些以早产分娩结束的怀孕。研究人员在女性的整个怀孕期间的每次预约中都收集了她们的阴道微生物组样本。与其他研究一样,研究人员以身体其他部位作为参照研究了这些样本,同时收集分娩时的脐带血和胎盘组织以及其他微生物样本。研究人员鉴定出与早产相关的某些细菌类群。最令人惊讶的是,这些信号在怀孕早期时似乎最大,而不是在接近分娩时。之前的研究已表明在怀孕的前三个月,阴道微生物组是非常多样化的,但是整个妊娠期间,这种多样性会减少,微生物群落变得以乳酸杆菌为主。在这项新的研究中,潜在早产的迹象随着微生物多样性的减少而消失。
有没有想过为什么一种对别人有效的药物对你似乎没有效果?你可能想要检查一下你的肠道来寻找答案。研究人员已经找到了加工150多种药物的肠道细菌,他们还发现了赋予这种细菌这种能力的基因。耶鲁大学研究小组称,这一发现强调了肠道细菌在人们对药物的反应中所起的作用。
在这项新的研究中,研究人员调查了271种药物是否以及如何被76种肠道细菌进行代谢。研究结果显示,近三分之二的药物被至少一种细菌代谢。研究人员随后确定了许多使细菌代谢药物的基因。
研究小组发现,健康人群中这些基因的数量存在很大差异。在某些情况下,这些差异解释了为什么有些人的肠道细菌群(微生物群)能快速代谢药物,而另一些人对同一种药物的反应很慢或根本没有。
由哈佛大学T.H.Chan公共卫生学院、麻省理工和哈佛Broad研究所的研究人员完成的一项新研究是第一个观察到扰乱微生物和触发炎症性肠病(IBD)发病期间免疫反应的复杂的化学和分子事件的研究,包括克罗恩病和溃疡性结肠炎。在这项研究中,研究人员对132名参与者进行了为期一年的跟踪研究,并将克罗恩病和溃疡性结肠炎患者与一组没有患有IBD的对照组进行了比较。参与者每两周提供一次粪便样本,大约每季度提供一次血液样本,并在研究开始时提供一组结肠活检以进行分析。总计2965例粪便、活组织检查和血液样本被前所未有的分子、细胞和临床工具所分析,以了解该疾病的详细生物化学特征。
图片来源:Nature
结果显示,在疾病活动期间,IBD患者体内的微生物源性化学物质较少,他们推测这可能是多种因素综合作用的结果,包括有益的微生物代谢更少、营养吸收更差、肠道内的水或血液水平更高以及肠道运动更急。这些因素降低了肠道微生物生态系统的整体稳定性,导致IBD患者出现更多的免疫反应不当和对正常肠道微生物群的过度反应。具体来说,在疾病活动期,IBD患者的多不饱和脂肪酸水平较高,包括肾上腺素和花生四烯酸盐。研究人员还发现,烟酸几乎只存在于IBD患者的粪便中,IBD患者的肠道中维生素B5和B3的水平特别低。研究小组还发现,胆汁酸--一组由人类制造但由肠道微生物进行化学修饰的化合物--在IBD过程中也被破坏,这与微生物群的分子调控有关。这些细菌包括一组与Subdoligranulum属有关的细菌,几乎所有人都携带Subdoligranulum属的细菌,但在炎症过程中细菌数量减少,而这些细菌此前从未被分离出来或加以鉴定。
自闭症(ASD)会导致社交沟通和重复行为的各种困难。导致自闭症发生的因素有很多,包括遗传和环境影响,而且目前并没有经过批准的治疗方法。现在,使用小鼠模型,加州理工学院的研究人员发现肠道细菌直接导致小鼠的自闭症行为发生。相关结果发表在5月30日的《Cell》杂志上。"近年来,许多研究揭示了ASD患者和神经典型受试者之间肠道微生物组细菌组成的差异。然而,虽然此前的研究确定了潜在的重要关联,但它无法解决观察到的微生物组变化是否是患有ASD的结果,或者它们是否会导致症状。"
为了研究微生物群在小鼠自闭症行为中的作用,研究小组使用了在没有微生物的情况下生长的"无菌"小鼠实验动物。来自患有孤独症的儿童的肠道微生物通过粪便移植转移到这些小鼠中,并且将来自没有自闭症的人的样品移植到其他动物组中。
来自患有ASD的个体的具有微生物群的小鼠表现出自闭症样行为,而携带来自正常发育个体的微生物群的小鼠未显示出这些症状。具体来说,他们花在社交上与其他老鼠互动的时间较少,发声较少,并表现出重复的行为。这些症状类似于ASD患者的行为特征。
除了行为差异之外,用人ASD微生物群定植的小鼠也显示其脑中基因表达改变以及存在的代谢物类型的差异(代谢物是作为消化和微生物代谢的副产物产生的分子)。在这些小鼠中发现特别是两种代谢物的量较低:5-氨基戊酸(5AV)和牛磺酸。 ASD有时以脑中激发和抑制比例的不平衡为特征,因此研究人员对较低量的5AV和牛磺酸感兴趣,因为它们都会影响某些称为GABA受体的抑制性神经受体。
药物本是用于治疗很多患者,但是一些患者遭受这些药物的毒副作用。在一项新的研究中,来自美国耶鲁大学的研究人员给出了一种令人吃惊的解释---肠道微生物组(gut microbiome)。他们描述了肠道中的细菌如何能够将三种药物转化为有害的化合物。相关研究结果发表在2019年2月8日的Science期刊上,论文标题为"Separating host and microbiome contributions to drug pharmacokinetics and toxicity"。论文通讯作者为耶鲁大学微生物科学研究所的Andrew Goodman。论文第一作者为Goodman实验室的博士后研究员Michael Zimmermann和Maria Zimmermann-Kogadeeva。
在这项新的研究中,Goodman、Zimmermann、Zimmermann-Kogadeeva和Rebekka Wegmann研究了一种抗病毒药物,它的分解产物可引起严重的毒副反应,并确定了肠道细菌如何将这种药物转化为有害的化合物。他们随后将这种药物给予携带着经基因改造后缺乏这种药物转化能力的细菌的小鼠,并测量了这种毒性化合物的水平。利用这些数据,他们开发出一种数学模型,并成功地预测了肠道细菌在对第二种抗病毒药物和氯哌嗪(一种抵抗癫痫和焦虑的药物)进行代谢中的作用。这项研究发现20%至80%的源自这三种药物的循环有毒代谢物由肠道细菌产生。这些研究人员表示,这种新的模型能够潜在地识别出哪些患者最有风险经历许多药物的毒副作用,并帮助科学家们定制新的方法以便最大限度地降低这种风险。
在一项新的研究中,Vedanta Biosciences公司报道了一种新发现的抗肿瘤免疫机制,这种机制涉及人体肠道菌群诱导产生干扰素γ(IFNγ)的CD8+ T细胞在肠道和肿瘤中积累。这项研究是由日本庆应义塾大学医学院的Kenya Honda博士(也是Vedanta Biosciences公司的科学联合创始人)领导的。Honda及其团队鉴定并筛选出一种合理确定的源自人类微生物组的细菌菌株混合物,这种细菌菌株混合物利用这种抗肿瘤机制,并协同性地加强对免疫检查点抑制剂和免疫挑战作出的反应。
通过严格的筛选,Honda团队分离出一种组成确定的源自人类微生物组的共生菌混合物,并且这种共生菌混合物经证实能够最有效地诱导IFNγ+ CD8+ T细胞快速地和持续地积累。接受这种组成确定的共生菌混合物移植的小鼠同时被给予PD-1或CTLA4免疫检查点抑制剂时可在一系列肿瘤模型中显示出增强的治疗效果。鉴定出的共生菌菌株主要是人类微生物组中的稀有的低丰度组分,这代表着一种治疗策略的重要扩大机会。
这项研究首次证实协同增强免疫检查点抑制剂反应的源自人类微生物组的细菌混合物是能够被确定出来的。他们解决了将人类微生物组的复杂群落减少到几种合理确定的细菌物种所面临的挑战,这几种细菌物种能够诱导强大的免疫增强反应,并且直接将它们的活性与促进抗肿瘤免疫反应的途径相关联在一起。
这项研究还发现人类粪便样本在诱导结肠IFNγ+ CD8+ T细胞的能力方面表现出相当大的差异性。Vedanta Biosciences公司的开发过程旨在通过使用从健康人体中分离出来的得到充分描述的细菌菌株的纯克隆细胞库来产生合理确定的组成一致的细菌菌株混合物,从而绕过这种差异性。这消除了依赖于从组成不一致的供者粪便材料中直接采样的需要。Vedanta Biosciences公司从来自四大洲的人类供者中获得的一个庞大的得到很好描述的由80000个细菌分离株组成的库存中获取细菌,据信这是最大的与人肠道相关的细菌库存。它随后开发出高通量测定方法来筛选针对一种给定疾病靶标的候选药物。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


