癌症免疫疗法研究新进展!
来源:本站原创 2019-08-28 08:20
本文中,小编整理了多篇亮点研究成果,共同解读近期科学家们在癌症免疫疗法研究上取得的新成果,分享给大家!图片来源:Cell【1】Cell:揭示增强免疫疗法疗效、对抗免疫抵抗性癌细胞的新方法doi:10.1016/j.cell.2019.06.014免疫疗法刺激病人的免疫系统对抗癌症。然而,尽管有很好的结果,但肿瘤细胞并不总是对这种治疗敏感。荷兰癌症研究所(Netherlands Cancer Ins
本文中,小编整理了多篇亮点研究成果,共同解读近期科学家们在癌症免疫疗法研究上取得的新成果,分享给大家!
图片来源:Cell
【1】Cell:揭示增强免疫疗法疗效、对抗免疫抵抗性癌细胞的新方法
doi:10.1016/j.cell.2019.06.014
免疫疗法刺激病人的免疫系统对抗癌症。然而,尽管有很好的结果,但肿瘤细胞并不总是对这种治疗敏感。荷兰癌症研究所(Netherlands Cancer Institute)的研究人员在Daniel Peeper教授的监督下,利用CRISPR/Cas9技术,在肿瘤细胞中发现了一些与治疗耐药性有关的基因。通过使这些基因失活,癌细胞可以对免疫治疗更加敏感,相关研究成果发表在Cell杂志上。
病人的免疫系统在对抗癌细胞方面起着重要的作用。特殊的免疫细胞(称为T细胞的白细胞)可以识别并杀死肿瘤。然而,有些肿瘤细胞以某种方式设法对抗这些免疫细胞,甚至对它们产生了抗药性。然后这些细胞可以自由地继续分裂。肿瘤有绕过免疫系统的方法,比如通过在细胞外产生某些蛋白质来抑制T细胞的活动。然而,在所谓的检查点抑制剂的帮助下,这些抑制蛋白可以被阻断,使T细胞重新发挥最佳功能,消除肿瘤。这使得免疫疗法成为对抗各种癌症的最新突破;有些病人甚至很长一段时间没有癌症。
doi:10.1016/j.cell.2019.07.019
在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现一种能够告诉免疫系统抵抗癌症的关键信号通路也可被癌细胞用来抑制免疫系统。他们说,这种增加的理解可作为一种有助于预测哪些患者可能对免疫疗法作出反应的生物标志物。他们还展示了改变这种平衡如何对治疗本身产生潜在影响,这是因为在多种临床前癌症模型中,阻断癌细胞中的这种信号有助于免疫细胞抵抗肿瘤,相关研究结果发表在Cell期刊上。
这项研究重点关注干扰素(IFN)信号通路。干扰素通常有助于激活免疫系统来保护细胞免受病毒入侵,并因此得名,这是因为它们实际上干扰了病毒的传播能力。然而,干扰素也会抑制免疫系统。研究者表示,这种自相矛盾的影响已出现在诸如慢性病毒感染之类的其他疾病中,但是我们的研究展示了癌细胞如何利用干扰素的抑制特性干扰癌症免疫疗法。
【3】Nature:科学家发现癌细胞上新的“别吃我”信号,新的免疫疗法即将来临
doi:10.1038/s41586-019-1456-0
近日,来自斯坦福大学医学院的研究人员发现了一种新的信号,癌症似乎可以利用这种信号逃避免疫系统的检测和破坏。科学家们已经证明,在植入人类癌症的老鼠体内阻断这种信号可以让免疫细胞攻击癌症。阻止其他"不要吃我"的信号已经成为其他可能的抗癌疗法的基础。
通常,被称为巨噬细胞的免疫细胞会检测到癌细胞,然后吞噬它们。近年来,研究人员发现,细胞表面的蛋白质可以告诉巨噬细胞不要进食并摧毁它们。这可以帮助正常细胞阻止免疫系统攻击它们,但是癌细胞利用这些"不要吃我"的信号来躲避免疫系统。研究人员此前已经证明,癌症细胞利用PD-L1、CD47保护自己免受免疫细胞的侵袭。阻断CD47的抗体正在临床试验中。以PD-L1或PDL1受体为靶点的癌症治疗正在临床得到应用。
【4】Nature Nat Medicine:癌症免疫疗法新突破!工程化细菌充当“特洛伊木马”有效抑制肿瘤进展!
doi:10.1038/s41591-019-0498-z doi:10.1038/nature18930
目前,合成生物学的新兴领域—设计新型的生物组分和系统正在彻底改变医学的进展,通过对活细胞的遗传编程,研究人员就能够开发出智能感知并对多种环境做出反应的工程化系统,与当前基于分子的疗法相比,这种新型系统能够产生更加具体且有效的解决策略。近日,一项刊登在国际杂志Nature Medicine上的研究报告中,癌症来自哥伦比亚大学的研究人员通过研究克服了上述问题,研究人员通过对一种非致病菌进行工程化修饰,使其能够在实体瘤中定植,并且能够安全地提供有效的免疫疗法,这种工程化改造的非致病菌或能扮演“特洛伊木马”来帮助抵御肿瘤。研究者指出,这种新型疗法不仅能够使淋巴瘤小鼠模型集体的肿瘤完全消退,还能够有效控制机体远端并未进行注射的肿瘤病变。
研究者Tal Danino教授说道,发现未经治疗的肿瘤与原发病灶对疗法同时产生反应让我们非常意外,这是继细菌性癌症疗法后第一个被称为“局部效应”的证明;这意味着,我们能够针对局部主要的肿瘤对细菌进行工程化修饰,随后刺激宿主机体的免疫系统来寻找成像或其它手段无法检测到的肿瘤和转移。这项研究中,研究者将合成生物学技术和免疫学技术相结合对细菌进行工程化修饰使其能够在肿瘤的核心区域生长并增殖;当细菌的数量达到一个临界阈值时,非致病性的大肠杆菌就会进行编程产生自毁,随后就能释放疗法,同时还能防止对机体其它部位造成破坏。随后,一小部分细菌会通过裂解存活下来并且重新开始繁殖,其能够允许在治疗过的肿瘤中进行多次药物传递。
【5】PNAS:靶向TOX和TOX2有望改善CAR-T细胞免疫疗法对实体瘤的治疗
doi:10.1073/pnas.1905675116
在一项新的研究中,Rao实验室和Hogan实验室在一个建立并维持T细胞衰竭的广泛基因表达网络中,提供了一个更为完整的参与者列表。这项研究利用小鼠模型发现通过基因手段清除两个新的转录因子--- TOX和TOX2---也会改善CAR-T方法中对“实体”黑色素瘤的根除。它表明在患者中靶向NR4A和TOX因子的类似干预措施可能将基于CAR-T的免疫疗法的应用扩展到实体瘤中,相关研究结果发表在PNAS期刊上。
他们首先比较了正常的与“衰竭的”T细胞样本中的基因表达谱,寻找与NR4A同时上调的因子作为T细胞功能障碍的同谋者。研究者表示,我们发现两种称为TOX和TOX2的DNA结合蛋白与NR4A转录因子一起高度表达。这一发现表明诸如NFAT或NR4A之类的因子可能会控制TOX的表达。他们随后在小鼠中重现CAR-T方案:首先将黑色素瘤细胞接种到小鼠体内以建立肿瘤,然后在一周后给这些小鼠灌注两种T细胞群体中的一种:来自正常小鼠的“对照”T细胞样本;来自经过基因改造后T细胞中不表达TOX和TOX2的小鼠的T细胞样本。
图片来源:University of Michigan Rogel Cancer Center
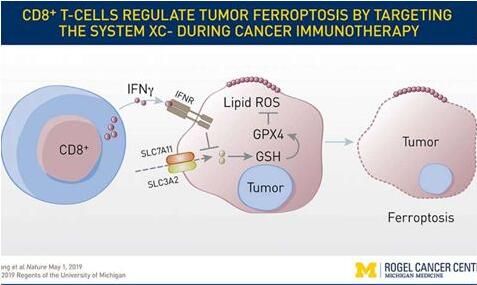
【6】Nature:重大发现!靶向铁死亡有望增强免疫疗法的疗效
doi:10.1038/s41586-019-1170-y
在一项新的研究中,来自美国密歇根大学和Cayman Chemical公司的研究人员研究了一种鲜为人知的细胞死亡类型,即铁死亡(ferroptosis)。他们发现铁死亡在肿瘤细胞中发生,并且在癌症免疫中发挥作用。这些发现表明靶向这一途径有潜力让最热门的癌症治疗---免疫疗法---更加有效,相关研究结果发表在Nature期刊上。
研究者表示,铁死亡之前已被定义,但是人们并不知道它与癌细胞死亡或免疫细胞有关,这将为科学家们探索开辟了一个巨大的窗口。这些研究人员发现当免疫疗法增强T细胞的活性时,这会增加肿瘤细胞中的氧化脂质水平,从而导致铁死亡。基于对小鼠和人癌细胞的研究,增加的铁死亡会让免疫疗法更有效地杀死癌症。铁死亡是一种细胞死亡形式,不同于更为人熟知和充分研究的细胞凋亡。它依赖于铁,但对它的理解知之甚少。已知它参与大脑和肾损伤。这项研究是首次将它与免疫介导的癌细胞死亡相关联在一起。
【7】OncoImmunology:发现人体内可以增强抗肿瘤免疫疗法的天然分子
doi:10.1080/2162402X.2019.1608106
利用免疫细胞刺激身体攻击肿瘤的癌症疗法,可以通过一种增强其功能的分子得到改善。对老鼠的研究发现,改进后的疗法产生了强大的抗癌免疫反应,导致了肿瘤缩小。初步实验表明,这种分子对人体细胞有类似的作用,并可能促进癌症治疗的成功。这种被称为LL-37的分子是人体对感染的自然反应,有助于杀死有害的细菌和病毒。
来自爱丁堡大学的科学家发现,它还影响免疫细胞,增强它们的功能。特别是这种分子增强了特定细胞的功能,这些细胞负责启动被称为树突状细胞的靶向免疫反应。树突状细胞已被用于癌症治疗,因为它们可以触发其他免疫细胞识别和攻击肿瘤。这种方法通常包括取患者自身细胞的样本,在实验室特殊条件下培养,然后再注入患者体内。这一过程成本高昂,而且由于难以制备足够数量的树突状细胞而受阻,这些细胞具有用于治疗的正确特性。
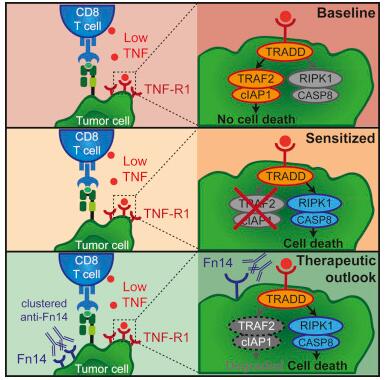
【8】Nature:预先抑制TNF显著增强PD-1和CTLA-4联合免疫疗法疗效并降低副作用
doi:10.1038/s41586-019-1162-y
由Cima和纳瓦拉临床大学的研究人员领导的一项合作实验研究提出了一种治疗癌症的新方法,即在动物模型中使用联合免疫疗法解决疗效和毒性的问题。这种临床策略包括阻断一种参与免疫系统调节的蛋白(称为肿瘤坏死因子,TNF),同时联合免疫治疗(抑制PD-1和CTLA-4等其他“减缓”免疫反应的蛋白),相关研究成果于近日发表在Natrue杂志上。
研究者表示,在这项研究中,我们发现肿瘤坏死因子的免疫调节功能是可有可无的,甚至在某种程度上对这种联合免疫疗法有害,我们已经在这些动物模型中证实,免疫治疗前预防性阻断TNF可以避免不良反应,提高治疗反应。这使我们能够更好地调整药物的剂量,从而达到更强的抗肿瘤效果。
【9】Cancer Res:突破!科学家鉴别出癌症免疫疗法的潜在新型靶点:GARP
doi:10.1158/0008-5472.CAN-18-2623
据美国癌症协会数据显示,结直肠癌是男性和女性因癌症死亡的第三大原因,尽管目前在这类癌症的治疗上取得了显著进展,但结直肠癌患者的5年生存率也仅有12%。近日,一项刊登在国际杂志Cancer Research上的研究报告中,来自南卡罗来纳医科大学的科学家们通过研究发现了一种潜在的针对结直肠癌免疫治疗的新靶点。
与PD-1相似,GARP是机体免疫细胞表面表达的一种特殊蛋白,研究者Li及同事希望能通过靶向作用GARP蛋白来作为一种新型疗法治疗对其它免疫疗法并无反应的结直肠癌患者。Li说道,在癌症治疗方面,免疫系统中有许多我们能够利用的地方,PD-1检查点疗法就是其中一种,研究者认为GARP也是其中一个可以利用的靶点。
研究人员非常感兴趣研究Tregs细胞在耐受性和癌症等多种疾病中是如何被调节的,他们对临床前模型进行研究发现,干扰GARP就能够降低癌症的耐受性,抑制结肠癌的发展,并抑制Treg细胞迁移到肠道组织中。Li说道,我们发现调节性T细胞表面的GARP对于免疫耐受性非常重要,其似乎还与肠道癌症的免疫逃逸机制有关。
【10】Hepatology:一种新型的组合性免疫疗法有望阻断肝癌的进展
doi:10.1002/hep.30528
近日,一项刊登在国际杂志Hepatology上的研究报告中,来自加利福尼亚大学Moores癌症研究中心的科学家们通过研究发现,将一种合成性的dsRNA聚胞苷酸(dsRNA-polylC)和程序性死亡配体1抗体(PD-L1抗体)相结合或有望有效阻断小鼠模型肝细胞癌的进展,并能促进部分小鼠模型机体中的肿瘤完全缓解以及保持无肿瘤存活状态。
研究者Gen-Sheng Feng说道,肝癌远比我们想象中要复杂地多,最近我们发现,剔除标准的癌基因会加重肝癌,肝脏拥有非常特殊的免疫耐受微环境,这也就是为何研究人员无法通过阻断致癌信号来有效治疗肝癌的原因了,利用在世界范围内多项临床试验中使用的检查点抑制剂免疫疗法或许也会因为患者反应不良而产生不确定的结果。
这项研究中,研究者证实了此前在不同肝癌动物模型中的实验结果,他们发现,通过重编程巨噬细胞并激活自然杀伤细胞就能有效抑制肝脏肿瘤的开启,并能消除肿瘤开启细胞;此外研究者认为,通过增强先天性免疫力有望开发出一种肝癌预防性策略,这或将惠及很多肝癌高风险的慢性肝病患者。在分析为何polylC(聚胞苷酸)并不能产生肝癌的治疗效应上,研究者注意到,注射polylC能够潜在诱发肝脏中PD-L1的表达,随后研究人员将polylC与PD-L1抗体联合来检测这种组合性免疫疗法的作用效果。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


