Nat Biotechnol重大进展!揭示干细胞移植排斥反应的新机制
来源:本站原创 2019-08-27 06:47
2019年8月27日讯 /生物谷BIOON /——2006年,科学家们发现了一种"重新编程"成熟细胞的方法--例如,将成熟的皮肤细胞"重新编程"成干细胞,原则上,干细胞可以生成人体的任何组织或器官。许多人认为,这项突破性的技术进入临床并引领再生医学革命只是时间问题。这种想法认为,由于同一名患者将同时是这些所谓诱导多能干细胞(ipsCs)的供体和受体,这些细胞将被免疫系统视为"自我",不会出现困扰传
2019年8月27日讯 /生物谷BIOON /——2006年,科学家们发现了一种"重新编程"成熟细胞的方法--例如,将成熟的皮肤细胞"重新编程"成干细胞,原则上,干细胞可以生成人体的任何组织或器官。许多人认为,这项突破性的技术进入临床并引领再生医学革命只是时间问题。
但是,由于无法预见的挫折,包括令人惊讶的临床前发现,iPSCs来源的细胞移植常常被拒绝,甚至在重新引入细胞来源的机体之后,ipsCs也没有成为最初设想的灵丹妙药。
科学家们一直在努力理解为什么会出现这种排斥反应。但是一项由加州大学旧金山分校(UCSF)移植和干细胞免疫生物学(TSI)实验室与国家心脏、肺、血液研究所(NHLBI)移植基因组学实验室、斯坦福大学合作完成的最新研究表明成熟到ipsC转换过程可以使线粒体DNA发生突变。这些突变可以触发免疫反应,导致小鼠和人类排斥诱导多能干细胞,以及更普遍的干细胞移植。
"线粒体在再生医学领域的作用已经被很大程度上忽略了,但我们的实验室早期的努力建议他们可能影响干细胞移植的结果。"UCSF心脏外科Julien I.E. Hoffman 主席、发表在《Nature Biotechnology》上的最新研究的主要作者Tobias Deuse博士说道。"了解它们的作用很重要,这样我们才能可靠地控制我们的工程细胞的质量,确保干细胞产品可以移植到病人身上而不产生排斥反应。"
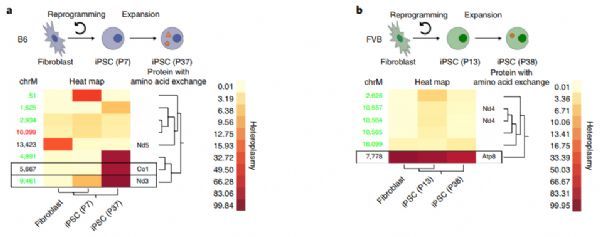
线粒体通常被称为细胞的动力源,它产生的能量为地球上几乎所有的生物过程提供燃料(没有线粒体的细菌是个例外)。但线粒体的特殊还有另一个原因:它们包含自己的基因组。
图片来源:Nature Biotechnology
人类的"核"基因组,之所以被称为"核"基因组,是因为它位于细胞核内,包含超过20,000个蛋白质编码基因和30亿个DNA碱基。相比之下,人类线粒体基因组只包含13个蛋白质编码基因和不到17000个碱基。然而,在高能量需求的组织中,微小的线粒体基因组对细胞的总蛋白含量的贡献不成比例。
"在做大量工作的细胞中,比如心肌细胞,多达三分之一的产生蛋白质的mRNA分子起源于线粒体。这意味着单个线粒体突变的负担可能是巨大的。你最终得到的不仅仅是一些可能引发免疫反应的蛋白质,而是数千种,"这项新研究的资深作者、外科教授、医学博士Sonja Schrepfer说。
为了证明这样的线粒体突变可以触发免疫反应,科学家们创造了混合干细胞,其细胞核DNA来自一种小鼠品系,线粒体DNA来自另一种小鼠品系。他们将这些细胞移植到具有相同核DNA的小鼠体内,但其线粒体DNA在两个蛋白编码基因中只有一个碱基不同。移植后几天,他们从小鼠身上获取免疫细胞,并将细胞暴露于各种线粒体蛋白片段中。唯一引起反应的蛋白质是由这两个"外来"线粒体基因产生的。
虽然类似的实验不能在人类身上进行,但科学家们想出了一个聪明的解决办法。Deuse说:"我们招募了肝脏和肾脏移植患者,设计了利用捐赠者和接受者线粒体DNA中自然发生的序列差异的实验。"
和在小鼠实验中一样,研究人员从每个移植受者身上分离出免疫细胞,并将细胞暴露于线粒体蛋白片段中。结果是一样的:受者的免疫细胞仅由来自器官供者的"外来"线粒体蛋白触发。
"在小鼠和人类中,即使一个线粒体突变也足以产生可识别的免疫反应,"Schrepfer说。
但一个重要的问题仍然存在:ipsCs衍生细胞的行为是否与肝细胞和肾细胞相同?
Deuse说,事实证明,ipsC的转化过程具有高度的诱变性,并导致许多新的、免疫激活的线粒体突变。"在正常的生理条件下,线粒体DNA比核DNA更容易发生突变,其易感性是核DNA的10到20倍。将成年细胞转化为干细胞是一个艰难的过程,所以我们预计突变率也会一样高或更高。"
此外,与细胞核不同,线粒体缺乏修复DNA的分子机制。相反,人体依靠免疫系统来寻找和破坏产生不熟悉线粒体蛋白的细胞--线粒体DNA发生突变的明显迹象。
但是成为间充质干细胞的细胞是经过重新编程并在体外生长的,免疫系统不会进行这种淘汰过程,Shrepfer说。"我们不是在有机体中制造iPSCs,而是在没有免疫监视的情况下,在培养皿中制造它们。我们培养这些细胞的时间越长,就越有可能引入新的突变,或者已经存在的非常罕见的突变会被放大。这使得ipsCs在移植时更容易被排斥。"
该研究的合作者,医学博士Hannah Valantine说,这些发现可能对移植领域产生重大影响。她的实验室进行了基因测序,以识别这些线粒体DNA突变。
但是,Deuse和Schrepfer说,iPSC移植并非注定要失败,他们之前发现了一种使iPSC对免疫系统"隐形"的方法--这种技术可以确保ipsC和其他线粒体突变的干细胞不会被排斥。但是,这项新研究表明,如果没有这种隐形斗篷,临床医生在使用干细胞疗法之前,可能需要仔细筛查线粒体突变。
"底线是我们想让人们意识到这种现象。仅仅因为诱导多能干细胞来自你自己的细胞并不一定意味着它们不会引起免疫反应。在iPSC生产过程中很容易引入突变,因此在移植前检测线粒体突变来筛选用于治疗的ipsC和干细胞产品是至关重要的。"(生物谷Bioon.com)
参考资料:
Tobias Deuse et al. De novo mutations in mitochondrial DNA of iPSCs produce immunogenic neoepitopes in mice and humans, Nature Biotechnology (2019). DOI: 10.1038/s41587-019-0227-7
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->