高度耐药结核病新药!美国FDA批准40多年来第三款抗结核新药Pretomanid
来源:本站原创 2019-08-20 10:06
2019年08月20日讯 /生物谷BIOON/ --非盈利组织TB Alliance(结核病联盟)近日宣布,美国食品和药物管理局(FDA)已批准新型化合物Pretomanid,作为三药、六个月全口服方案BPaL(由贝达喹啉、Pretomanid、利奈唑胺组成)的一部分,用于药物不耐受或无应答的广泛耐药结核病(XDR-TB)或耐多药结核病(MDR-TB)患者(统称为“高度耐药结核病”)的治疗。值得一
2019年08月20日讯 /生物谷BIOON/ --非盈利组织TB Alliance(结核病联盟)近日宣布,美国食品和药物管理局(FDA)已批准新型化合物Pretomanid,作为三药、六个月全口服方案BPaL(由贝达喹啉、Pretomanid、利奈唑胺组成)的一部分,用于药物不耐受或无应答的广泛耐药结核病(XDR-TB)或耐多药结核病(MDR-TB)患者(统称为“高度耐药结核病”)的治疗。
值得一提的是,Pretomanid是FDA在过去40多年来批准的第三款抗结核新药,同时也是首个由非盈利组织开发的抗结核药物。在美国,FDA已授予Pretomanid优先审查、合格传染病产品(QIDP)、孤儿药资格。
Pretomanid预计在年底前在美国上市。目前,该药也正在接受欧洲药品管理局(EMA)的审查。TB Alliance也已向世界卫生组织(WHO)提交了BPaL方案的临床数据,考虑将该方案纳入高度耐药结核病的治疗指南。
TB Alliance总裁兼首席执行官Mel Spigelman医学博士表示:“FDA批准这一治疗方案代表了患有世界上最致命的传染病的高度耐药结核病患者群体的胜利。这款新疗法有望为有需要的患者提供一种更短、更容易管理和高效的治疗方法。”
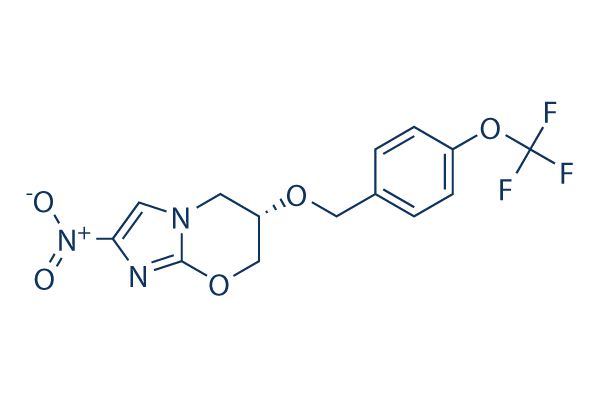
pretomanid分子结构式(图片来源:Wikipedia)
Pretomanid是一种新化学实体,属于名为硝基咪唑嗪类化合物。该药已在20项临床试验中单独或与其他抗结核药物联合进行了研究。自从2002年TB Alliance开始开发pretomanid以来,该药已在14个国家对1000多人进行了临床试验。
Pretomanid的新药申请包括了1168例患者的数据,这些患者在19项临床试验中接受了Pretomanid治疗。III期临床研究Nix-TB入组了109例XDR-TB以及药物不耐受或非反应性MDR-TB患者。数据显示,接受BPaL方案治疗6个月并在完成治疗后随访6个月,前107例患者中有95例患者取得了治疗成功——临床感染得到解决、TB痰培养呈阴性。有2例患者的治疗时间延长至9个月。该研究中,报告的不良反应包括肝毒性、骨髓移植、周围神经病变。
Nix-TB研究的首席调查员FrancescaConradie博士表示:“直到最近,高度耐药结核感染者的治疗选择和预后都很差。此次批准的这一新的治疗方案,为90%的患者在接受这种短疗程全口服方案完成治疗后6个月达到培养阴性状态提供了希望。”
结核病(tuberculosis,TB)是一种全球性疾病,在每个国家都有发现,是导致死亡的首要传染病。所有类型的结核病都必须采用药物联合治疗,对药物最敏感的结核病需要用4种抗结核药物治疗6个月。广泛耐药结核病或治疗不耐受/无应答的耐多药结核病的治疗疗程更长且非常复杂,大多数XDR-TB患者目前需要服用多达8种抗生素(部分需要每日注射)的组合方案治疗18个月或更长时间。根据WHO的报告,在近年来推出治疗耐药结核病的新药之前,XDR-TB疗法的成功率约34%,MDR-TB疗法的成功率约55%。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


