多项研究揭示癌细胞致命弱点,为攻克癌症带来新希望!
来源:本站原创 2019-08-02 13:15
2019年8月2日讯 /生物谷BIOON /——虽然人类已经不懈努力的研究了几十年,但是到目前为止还无法攻克癌症。然而研究人员已经发现了癌症不少的致命弱点,正在积极进行研究,基于这些致命弱点开发新的药物和疗法。因此本文中小编盘点了近期发现的癌症治疗新靶标,分享给大家。【1】Nature:蛋白过度表达可能是癌细胞的致命弱点DOI: 10.1038/s41586-019-1187-2在一项使用酵母细胞
2019年8月2日讯 /生物谷BIOON /——虽然人类已经不懈努力的研究了几十年,但是到目前为止还无法攻克癌症。然而研究人员已经发现了癌症不少的致命弱点,正在积极进行研究,基于这些致命弱点开发新的药物和疗法。因此本文中小编盘点了近期发现的癌症治疗新靶标,分享给大家。
在一项使用酵母细胞和癌症细胞系的研究中,约翰霍普金斯大学的科学家们报告说,他们发现在拥有额外染色体组的癌细胞中存在一个潜在的弱点。染色体组是携带遗传物质的结构。研究人员表示这种脆弱性根源于癌细胞的一个共同特征--细胞内蛋白质浓度高--这使它们看起来臃肿不堪,而且可能成为癌症治疗的新靶点,相关研究成果发表在《Nature》上。
这项新的实验主要关注的是染色体数目异常(非整倍体)。例如,正常的人类细胞有数量平衡的染色体:46条染色体或23对不同的染色体。染色体拷贝数多或少的细胞称为非整倍体。Li说:"非整倍体是癌症的首要特征。90%以上的实体肿瘤类型都存在非整倍体。当细胞获得染色体时,它们还会获得一组额外的基因,这些基因产生的蛋白质比细胞正常产生的蛋白质要多。这种过剩会赋予细胞正常情况下不具备的生长能力,有时会让细胞过度生长,发展成肿瘤。"
Li的团队继续研究,探索是否能利用非整倍体细胞的脆弱性来适当控制营养物质的摄入。他们对酵母基因组进行了筛选,发现了一种分子通路,其中包括两种名为ART1和Rsp5的蛋白质,它们调节细胞吸收葡萄糖和氨基酸等营养物质的能力。当科学家使非整倍酵母细胞中的这些蛋白质失活时,它们缺乏适当的细胞内营养水平,生长能力也较差。人类分子通路的类似物包括一种叫做arrestins和Nedd4的蛋白质。
【2】Cell Stem Cell:找到白血病的致命弱点!有效无毒的新疗法呼之欲出!
一项关于致命血癌的新发现可以帮助开发出比现有化疗副作用小得多的新药。这一发现可能导致新的治疗方法,在不损害健康血细胞的情况下,有效地消除急性髓性白血病(AML)患者体内的血癌细胞。研究人员发现了体内的一种蛋白质在白血病中起着关键作用。
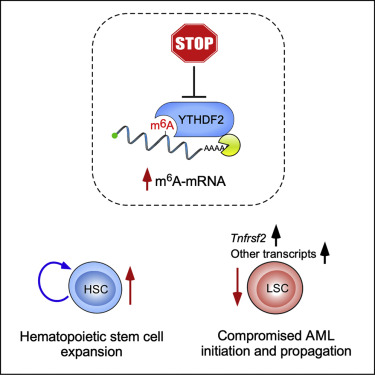
图片来源:Cell Stem Cell
白血病是一种恶性白细胞癌,存活率极低。研究表明,一种被称为YTHDF2的蛋白质是触发和维持疾病所必需的,但维持健康细胞的功能却不需要这个蛋白质。这表明YTHDF2是治疗白血病的一个有希望的药物靶点。由爱丁堡大学和伦敦玛丽女王学院联合领导的研究小组进行了一系列实验,研究了YTHDF2在血癌中的作用。
对白血病患者捐献的血液样本的测试显示,这种蛋白质在癌细胞中含量丰富,而小鼠实验发现,这种蛋白质是引发和维持疾病的必需物质。进一步的测试使科学家能够确定干扰YTHDF2功能的生物途径,通过这种途径可以选择性地杀死血癌细胞。重要的是,他们还发现该蛋白并不支持健康血液干细胞的功能,而健康血液干细胞负责所有正常血细胞的生成。事实上,在没有YTHDF2的情况下,血液干细胞更加活跃。
在一项新的研究中,来自美国沙克生物研究所、中国南方科技大学、加拿大多伦多大学等多家研究机构的研究人员猜测胰腺星状细胞与胰腺癌细胞之间的通信可能是一种可利用的靶标,用于开发治疗和诊断PDAC的有效策略。从对分泌性疾病调节物和内在分子机制的系统蛋白质组学研究开始,他们揭示出白血病抑制因子(leukaemia inhibitory factor, LIF)是活化的PSC作用于胰腺癌细胞的关键旁分泌因子。

图片来源:Nature
对LIF进行药物阻断和对Lifr进行基因剔除都会显着增加化疗的疗效,从而延长PDAC小鼠模型的存活,这主要是通过调节胰腺癌细胞分化和上皮-间质转化(EMT)状态实现的。再者,在小鼠模型和人PDAC中,胰腺中LIF的异常产生仅限于病理状况并且与PDAC发病机理相关,而且循环LIF水平的变化与肿瘤对治疗的反应存在良好的关联性。综上所述,这些发现揭示了LIF在PDAC肿瘤发生中的功能,并且指出它作为一种有吸引力的治疗靶标和循环标记物的转化潜力。这项研究强调了如何更好地理解肿瘤微环境中的细胞间通讯如何可能为癌症治疗提出新的策略。
和健康细胞相比,肿瘤细胞消耗糖的速度更快,但是它们也很需要氨基酸,这是构成蛋白质及其他生物大分子的基本元件。埃默里大学Winship癌症研究所的研究人员发现了一种新方式可以选择性抑制白血病细胞的生长,相关研究结果于近日发表在《Nature Metabolism》上。
由Cheng-Kui Qu博士领导的研究团队发现了转运酶ASCT2(负责将氨基酸转运进入细胞)是一个抗癌靶标,清除编码这个蛋白的基因可以显着延长患白血病(AML/急性髓系白血病)的小鼠的生存期(从45天延长到超过300天)。
Qu的研究团队检测了抑制ASCT2对于治疗移植了人AML细胞的小鼠的效果,结果发现效果惊人,但是他表示他们使用的药物疗效并非最佳,不适合用于临床。此外,其他研究人员已经发现了一种特殊的ASCT2抑制剂,该抑制剂也对其他种类的肿瘤具有杀伤效果。
来自加州大学圣地亚哥分校(UCSD)癌症研究所的研究人员发现抑制脑胶质瘤中一个特殊蛋白质的活性可以增加脑胶质瘤对放疗的敏感性,从而提高胶质瘤这种最常见、最恶性的脑癌的治疗,相关研究成果于近日发表在《Cancer Cell》上。
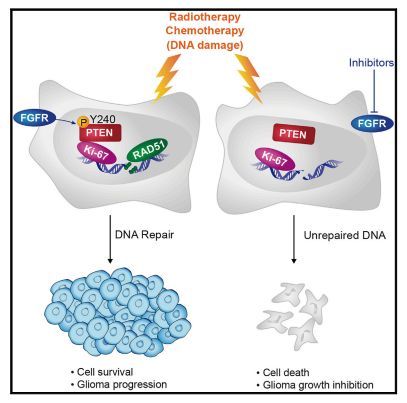
图片来源:Cancer Cell
脑胶质瘤非常难治疗,中位生存期仅为15-16个月。放疗和化疗是标准的治疗方法,都旨在损伤和破坏肿瘤细胞的DNA,但是它们的治疗疗效会随着肿瘤产生抵抗性而下降。在这项新研究中,UCSD药学院病理学教授Frank B. Furnari(通讯作者)、博士后研究员Jianhui Ma博士(第一作者)及其同事发现了胶质瘤用于促进治疗抵抗性的新机制:同源性磷酸酶-张力蛋白( phosphatase and tensin homolog,PTEN)的磷酸化,该蛋白由PTEN基因编码。
通常情况下该蛋白是一个肿瘤抑制蛋白,但是突变或者错误的修饰会产生相反的效果。特别是研究人员发现PTEN的磷酸化(酪氨酸Y240位点)会促进肿瘤细胞的DNA修复,从而逆转治疗性放疗的效果。当研究人员使用成纤维细胞生长因子受体抑制剂抑制小鼠胶质瘤细胞中Y240的磷酸化后,肿瘤细胞对放疗的敏感性增加,更多的肿瘤细胞死亡,因此小鼠的生存期显着延长。
癌细胞往往需要大量的"食物"来生存并生长,近日,一项刊登在国际杂志Nature上的研究报告中,来自德克萨斯大学MD Anderson癌症中心的科学家们发现了一种能饿死胰腺癌细胞的新方法;文章中研究者利用了一种先进的方法来追踪胰腺癌细胞如何重排细胞表面的蛋白质,名为多配体蛋白聚糖-1(SDC1)的蛋白质能移动到细胞表面来对突变的KRAS信号产生反应,KRAS蛋白存在于超过90%的胰腺导管腺癌中。
研究者指出,细胞表面SDC1的定位对于胰腺癌细胞上调巨胞饮(macropinocytosis)过程非常重要,巨胞饮是细胞用来从周围环境中净化资源从而转化为能量或促进细胞分裂的一种机制,尽管胰腺癌细胞中突变的KRAS能够激活巨胞饮过程,但控制该过程的分子机制目前研究人员并不清楚,研究者发现,SDC1能对来自KRAS的信号产生反应并在细胞表面积累从而诱导上述途径。
研究者指出,细胞表面SDC1的定位对于胰腺癌细胞上调巨胞饮(macropinocytosis)过程非常重要,巨胞饮是细胞用来从周围环境中净化资源从而转化为能量或促进细胞分裂的一种机制,尽管胰腺癌细胞中突变的KRAS能够激活巨胞饮过程,但控制该过程的分子机制目前研究人员并不清楚,研究者发现,SDC1能对来自KRAS的信号产生反应并在细胞表面积累从而诱导上述途径。
来自新加坡国立大学新加坡癌症科学研究所(CSI新加坡)的一组研究人员进行的一项研究表明,脂肪肉瘤(LPS)是一种从脂肪细胞发展而来的癌症,而这种癌变过程需要关键蛋白的参与。在最近发表在Nature Communications上的研究中,研究人员发现LPS的发展高度依赖于BET蛋白的存在,使得BET蛋白质家族成为癌症的有希望的靶点。
新加坡国立大学的研究人员将研究重点放在复发性LPS上。通过详细分析在癌症复发或对标准疗法有抗性的患者样本中影响LPS发展的遗传因素,研究人员发现LPS中的主要DNA转变程序是由BET蛋白介导的。研究人员随后使用BET蛋白降解剂ARV-825研究了其对LPS恶化的抑制作用,发现它能够破坏LPS中的核心转录程序,并通过消耗BET蛋白来预防癌症的发展。此外,研究人员观察到对trabectedin具有抗性的LPS细胞也对BET蛋白的消耗敏感,从而使BET蛋白成为一种有希望的靶标,不仅可以抑制LPS的发展,而且可以克服对化疗药物的获得性抗性。
以加州大学圣地亚哥医学院和加州大学圣地亚哥路德维希癌症研究所为首的一个研究小组的科学家们已经确定了一种酶参与重建多个癌症细胞的质膜,而这对肿瘤生存和不受控制的生长是至关重要的。这一发现于近日发表在《Cell Metabolism》杂志上,暗示了新药的潜在目标。

图片来源:Cell Metab
在新由Benjamin Cravatt博士领导、Junfeng Bi作为主要负责人的研究中,研究人员发现癌症患者体内一种叫做LPCAT1的酶的水平会增加,它通过改变肿瘤细胞的质膜的磷脂组成在肿瘤生长中起着关键作用,允许放大和突变的生长因子信号刺激肿瘤的生长。没有LPCAT1,肿瘤无法存活。当研究人员将多种类型的小鼠癌症(包括高致命性的胶质母细胞瘤(脑)和侵袭性肺癌)中的LPCAT1基因敲除后,恶性肿瘤大幅减少,生存时间得到改善。作者写道,研究结果表明,LPCAT1是一种重要的酶,在癌症中变得失调,将肿瘤的常见基因改变与代谢变化联系起来,从而推动肿瘤的侵袭性生长。"
德克萨斯大学安德森癌症中心的一项研究确定了癌细胞的一个新的治疗靶点,并解释了名为imipridones的新型抗癌药物是如何通过诱导血癌(如急性髓系白血病(AML)和套细胞淋巴瘤)中的癌细胞死亡而发挥作用的。
该研究揭示了线粒体中的一个靶点,称为酪蛋白水解蛋白酶P (caseinolytic protease P,ClpP),它在激活时分解线粒体内的蛋白质,这一过程被称为线粒体蛋白水解。一种名为imipridones的新型抗癌药物被证明可以激活ClpP,并通过线粒体蛋白水解导致癌细胞死亡。
-哈佛医学院和Dana-Farber癌症研究所的科学家已经开发出一种方法,利用化学抑制剂的多靶点性质来杀伤癌细胞。
在发表在《Journal of Biological Chemistry》杂志上的一项研究中,研究者们确定了支持特定类型肺癌细胞存活的关键分子。通过分析这些细胞对具有多种靶标的癌症杀伤激酶抑制剂的反应,他们能够证明通过同时抑制两种信号传导途径中的特定分子可能引发抗癌作用。这种药物靶标发现方法可用于设计选择性攻击多种蛋白质的药物,这有利于管理某些肿瘤。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


