2019年7月Cell期刊不得不看的亮点研究
来源:本站原创 2019-07-31 23:12
2019年7月31日讯/生物谷BIOON/---2019年7月份即将结束了,7月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Cell:新方法简化人类人工染色体构建doi:10.1016/j.cell.2019.06.006在过去的20年中,科学家们一直在努力完善人类人工染色体(human artificial chromosome, HAC)的构建。在一项新的研究
2019年7月31日讯/生物谷BIOON/---2019年7月份即将结束了,7月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:新方法简化人类人工染色体构建
doi:10.1016/j.cell.2019.06.006
在过去的20年中,科学家们一直在努力完善人类人工染色体(human artificial chromosome, HAC)的构建。在一项新的研究中,来自美国宾夕法尼亚大学的研究人员通过绕过形成天然染色体所需的生物学要求,描述了一种形成HAC的一个重要部分---着丝粒---的新方法。简言之,他们通过生化手段将一种称为CENP-A的蛋白直接运送到HAC DNA上,从而简化实验室中的HAC构建。相关研究结果发表在2019年7月25日的Cell期刊上,论文标题为“Human Artificial Chromosomes that Bypass Centromeric DNA”。
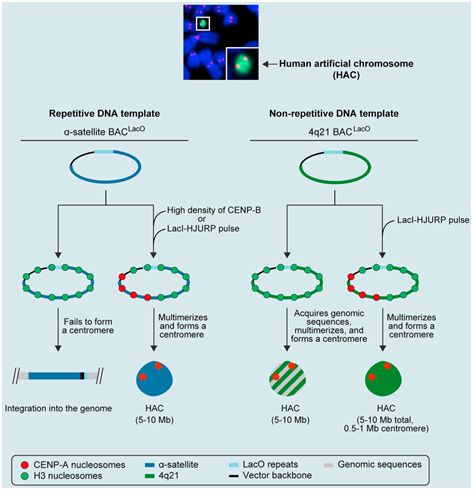
论文通讯作者、宾夕法尼亚大学佩雷尔曼医学院生物化学与生物物理学教授Ben Black博士说道,“我们取得的进展简化了HAC的构建和表征,从而有助于人工制造全人类染色体。”
论文第一作者Glennis Logsdon说道,“想象我们构建的HAC是模型大小的染色体。通过能够以一种更直接的方式构建出HAC上的着丝粒,我们更接近于扩大到全尺寸的染色体。”
2.Cell:重大进展!靶向TMED9蛋白有往治疗多种毒性蛋白病
doi:10.1016/j.cell.2019.07.002
科学家们早就知道,数十种称为毒性蛋白病(toxic proteinopathy)的遗传性疾病,是由细胞中特定错误折叠蛋白的堆积引起的。但是,负责这种堆积的分子机制仍然是个谜,这就阻止了开发相应疗法的努力。
如今,在一项新的研究中,来自美国布罗德研究所、哈佛医学院和布莱根妇女医院的研究人员发现一些毒性蛋白病可能起源自一个以前未被认识到的原因:细胞运输网络(称为分泌途径)中单个特定步骤发生堵塞,其中这种细胞分泌途径要么将蛋白递送至细胞表面,要么将蛋白递送至细胞中的蛋白处理系统之一。相关研究结果发表在2019年7月25日的Cell期刊上,论文标题为“Small Molecule Targets TMED9 and Promotes Lysosomal Degradation to Reverse Proteinopathy”。
这一发现来自对一种称为MUC1肾病(MUC1 kidney disease, MKD)的罕见疾病的研究,在这种疾病中,这些研究人员发现它起源自肾细胞中MUC1蛋白的错误折叠版本的有害堆积。此外,他们发现肾细胞未能移除这种错误折叠蛋白可追溯到这种细胞分泌途径中的一个特定分子步骤,而且显而易见的是,一种称为BRD4780的化合物能够清除这种堵塞。这种化合物在人肾细胞、肾脏类器官(患者细胞经改造后在培养皿中产生的微型肾脏)和MKD动物模型中起作用。BRD4780可能是开发治疗MKD和其他毒性蛋白病的新药物的起点。不过就目前而言,人们尚没有针对这些毒性蛋白病的治疗方法。
论文通讯作者、哈佛医学院副教授、布罗德研究所肾病计划主任、布莱根妇女医院肾脏专家Anna Greka说道,“我想到的是在研究MKD致病机制的过程中,我们发现了关于细胞如何处理错误折叠蛋白的迷人的新生物学特性,这些关键的新见解可能有助于我们解决几种破坏性疾病。我们的研究团队正在全天候工作,旨在将这些发现转化为我们能够尽快为患者带来的新疗法。”
3.Cell:挑战常规!延缓代谢可阻止有害的基因突变
doi:10.1016/j.cell.2019.06.023
在一项新的研究中,来自美国西北大学的研究人员发现将突变果蝇的代谢率降低50%,它们携带的很多突变的预期有害影响就从未表现出来。在通过实验测试这些果蝇的许多不同基因突变后,他们每次都发现了相同的结果。相关研究结果于2019年7月25日在线发表在Cell期刊上,论文标题为“Repressive Gene Regulation Synchronizes Development with Cellular Metabolism”。

论文共同通讯作者、在西北大学领导实验研究的Richard Carthew说道,“当这些突变果蝇以正常的代谢率发育时,发育问题就出现。当我们降低它们的代谢率时,发育问题就会消失。它们发育得更慢,生长得更慢,但是它们是正常的动物。”
论文共同通讯作者、在西北大学领导计算研究的Luís Amaral补充道,“这推翻了我们所知道的关于发育的一切模式。我们总是认为如果‘破坏’了一些基因,那么这就会产生严重的发育后果。事实证实对于某些基因来说,这是不正确的---只要你也延缓了生长中的有机体的代谢。”
4.Cell:研究揭示了侵袭性脑癌很难治疗的原因
doi:10.1016/j.cell.2019.06.024
胶质母细胞瘤是一种无法治愈的脑癌,大多数患者在确诊后不到两年就会死亡。这种疾病很难治疗,主要是因为每种肿瘤都含有多种细胞。侵袭性脑癌在患者之间也有很大的差异,以至于研究人员争论是否应该将胶质母细胞瘤视为一种单一的疾病。一项新的研究可能有助于阐明是什么导致了这种重要的异质性,并使胶质母细胞瘤如此致命。
研究者对从20成人和8个儿科胶质母细胞瘤患者身上获得的超过24000多个肿瘤细胞及实验室胶质母细胞瘤模型进行了基因表达分析。他们发现胶质母细胞瘤细胞存在4个状态,每一个都有一个独特的基因表达程序,这些程序一起导致了肿瘤出现极大的变化。科学家们随后利用单细胞数据重新分析了癌症基因组图谱中的胶质母细胞瘤数据,并确定了与这四种状态相关的基因变化。
5.Cell:研究提出更好的减肥药!科学减肥指日可待!
doi:10.1016/j.cell.2019.05.048
有效的减肥策略要求吃更少的食物,燃烧更多的卡路里--或者理想情况下,两者兼而有之。但是,对于9000多万患有肥胖症的美国人来说,行为改变很难实现,或者效果不够,这就是为什么科学家们长期以来一直在寻找能够帮助人们减肥的药物。肥胖症会导致从癌症到心脏病等多种疾病。然而,到目前为止,有效、持久的治疗方法一直未能奏效。
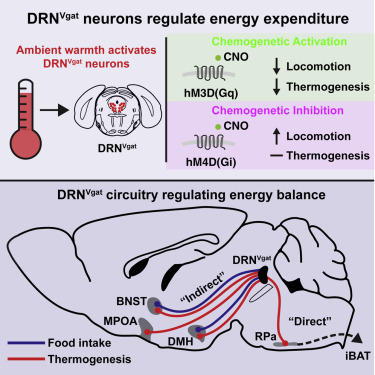
在Cell杂志上发表的一篇新报告中,Jeffrey M. Friedman实验室的研究人员提出了一条寻找抗肥胖药物的新途径。他们与普林斯顿大学的一个研究小组合作,发现一组先前被证明可以调节饥饿的脑细胞也可以控制能量消耗。由于我们的体重既取决于我们消耗的卡路里,也取决于我们消耗的能量,这些发现可能会导致一种新型减肥药,它在能量方程式的两边都起作用。
6、7.背靠背两篇Cell揭示肺癌转移新机制
doi:10.1016/j.cell.2019.06.005; doi:10.1016/j.cell.2019.06.020
瑞典和美国的研究人员在两项独立研究中报告说,肺癌细胞通过激活一种名为BACH1的蛋白质增加糖的摄取和使用,利用内源性或饮食中的抗氧化剂在体内扩散。这些发表在著名科学杂志《Cell》上的研究为新的肺癌治疗策略铺平了道路。
众所周知,癌细胞由于其特殊的代谢作用,会受到由自由基引起的氧化应激的影响。癌细胞的特征是高摄取和高利用葡萄糖,这是控制癌细胞分裂和转移能力的众多因素之一。通过对小鼠和人体组织的研究,两个独立的研究小组现在已经揭示了当癌细胞转移到身体其他部位时,这些环境是如何相互作用的。
当癌细胞减少氧化应激时,这个过程就开始了。氧化应激可以通过两种方式之一发生:癌细胞可以从饮食中获得抗氧化剂,如维生素A、C或E,或者合成它们自己的抗氧化剂。在大约三分之一的肺癌病例中,肿瘤细胞具有与NRF2和KEAP1基因相关的特殊突变,这些突变使它们能够开始产生自己的抗氧化剂。
当氧化应激消退时,新发现的基本过程就发生了: BACH1蛋白稳定下来,并在癌细胞中积累。这种蛋白质在癌细胞中按下几个启动按钮,从而刺激癌细胞的转移机制,包括一个命令癌细胞将葡萄糖代谢为细胞燃料和乳酸,并从血液中储存葡萄糖的机制。葡萄糖的使用速率越高,癌细胞扩散的能力就越强。
8.Cell:揭秘人类细胞如何对外部环境信号产生反应并加工处理
doi:10.1016/j.cell.2019.04.044
近日,一项刊登在国际杂志Cell上的研究报告中,来自海德堡大学等机构的科学家们通过研究利用新型的生物技术方法分析了人类细胞如何对外部信号产生反应并加工处理。文章中,研究者重点对G蛋白及其受体GPCRs之间的相互作用进行研究,G蛋白是信号传输的介导子,而GPCRs则会诱发信号过程。
研究者表示,他们不仅能够更好地理解GPCRs-G蛋白之间的相互作用,还能够有效预测这两者的功能。所有的有机体均能对来自环境中的外部信号产生反应,在人类和其它动物中,这些信号能被细胞膜中的受体(与G蛋白进行偶联)检测到并加工处理,GPCRs是最大的跨膜受体家族,其能对大量细胞外的物理化学信号产生反应,并诱发细胞中的特殊过程,其中一种方法就是与一种或多种G蛋白进行偶联,这项研究中,研究人员就对这些偶联过程进行了深入研究分析。
人类机体中拥有16种G蛋白,其能与近乎1000种GPCRs相互偶联,利用生物技术工具和机器学习手段,研究人员就能对148有代表的受体和11种蛋白进行深入研究来理解GPCRs-G蛋白之间的相互作用,随后研究者揭开了数百种GPCRs-G蛋白之间的偶联事件,这或许能够帮助理解GPCRs的工作机制。
9.Cell突破:发现抑制阿尔兹海默症蛋白聚集的通路
doi:10.1016/j.cell.2019.05.056
圣犹大儿童研究医院的科学家们发现了一种像洗车一样的方法,可以防止与阿尔兹海默症相关的有毒蛋白质的积聚。该报告于近日发表在《Cell》杂志上。
这项在小鼠阿尔兹海默症模型中进行的研究为治疗这种慢性神经退行性疾病提供了一个可能的新方法,它是美国的第六大死因。这种新发现的途径也有助于调节炎症,所以这项发现可能产生策略释放针对恶性脑瘤的免疫反应。
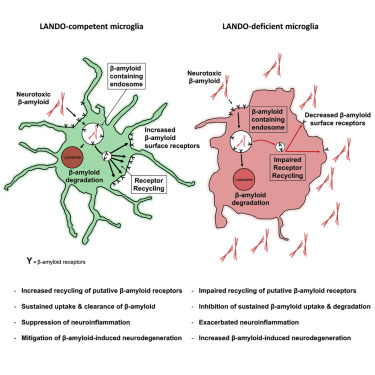
研究人员称这种途径为LC3相关的内吞作用或LANDO。他们在大脑和中枢神经系统的主要免疫细胞小胶质细胞中发现了这种途径。然而,初步证据表明,LANDO是一个在全身细胞都发挥功能的基本的过程。
研究人员发现LANDO可以防止老鼠的神经毒性β-淀粉样蛋白质沉淀。该通路的激活还可以预防毒性神经炎症和神经退化,包括记忆问题。
10.Cell:意外!太多维生素E等抗氧化剂反而会导致肺癌转移
doi:10.1016/j.cell.2019.06.003
一项新的研究解释了为什么肺癌在某些基因发生变化的患者中传播得更快,并表明长期以来被认为是预防措施的维生素E可能会导致同样的传播。由纽约大学医学院(NYU School of Medicine)和珀尔马特癌症中心(Perlmutter Cancer Center)的研究人员领导、在小鼠和人类组织中进行的实验揭示了BACH1蛋白与癌细胞迁移和组织侵袭之间的关系。
6月27日发表在《Cell》杂志上的这项研究结果反映了癌细胞的性质。癌细胞产生于一个地方,但经常扩散(转移)并在其他地方生根。肺癌转移是美国癌症死亡的主要原因。
"我们的结果最后阐明了BACH 1信号周围的网络机制,表明一类已批准的药物可以对抗约30%的癌症扩散的患者。"高级研究作者、医学博士Michele Pagano说道,他是纽约大学医学院的生物化学和分子药理学部门的主席。(生物谷 Bioon.com)
1.Cell:新方法简化人类人工染色体构建
doi:10.1016/j.cell.2019.06.006
在过去的20年中,科学家们一直在努力完善人类人工染色体(human artificial chromosome, HAC)的构建。在一项新的研究中,来自美国宾夕法尼亚大学的研究人员通过绕过形成天然染色体所需的生物学要求,描述了一种形成HAC的一个重要部分---着丝粒---的新方法。简言之,他们通过生化手段将一种称为CENP-A的蛋白直接运送到HAC DNA上,从而简化实验室中的HAC构建。相关研究结果发表在2019年7月25日的Cell期刊上,论文标题为“Human Artificial Chromosomes that Bypass Centromeric DNA”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.06.006。
论文通讯作者、宾夕法尼亚大学佩雷尔曼医学院生物化学与生物物理学教授Ben Black博士说道,“我们取得的进展简化了HAC的构建和表征,从而有助于人工制造全人类染色体。”
论文第一作者Glennis Logsdon说道,“想象我们构建的HAC是模型大小的染色体。通过能够以一种更直接的方式构建出HAC上的着丝粒,我们更接近于扩大到全尺寸的染色体。”
2.Cell:重大进展!靶向TMED9蛋白有往治疗多种毒性蛋白病
doi:10.1016/j.cell.2019.07.002
科学家们早就知道,数十种称为毒性蛋白病(toxic proteinopathy)的遗传性疾病,是由细胞中特定错误折叠蛋白的堆积引起的。但是,负责这种堆积的分子机制仍然是个谜,这就阻止了开发相应疗法的努力。
如今,在一项新的研究中,来自美国布罗德研究所、哈佛医学院和布莱根妇女医院的研究人员发现一些毒性蛋白病可能起源自一个以前未被认识到的原因:细胞运输网络(称为分泌途径)中单个特定步骤发生堵塞,其中这种细胞分泌途径要么将蛋白递送至细胞表面,要么将蛋白递送至细胞中的蛋白处理系统之一。相关研究结果发表在2019年7月25日的Cell期刊上,论文标题为“Small Molecule Targets TMED9 and Promotes Lysosomal Degradation to Reverse Proteinopathy”。
这一发现来自对一种称为MUC1肾病(MUC1 kidney disease, MKD)的罕见疾病的研究,在这种疾病中,这些研究人员发现它起源自肾细胞中MUC1蛋白的错误折叠版本的有害堆积。此外,他们发现肾细胞未能移除这种错误折叠蛋白可追溯到这种细胞分泌途径中的一个特定分子步骤,而且显而易见的是,一种称为BRD4780的化合物能够清除这种堵塞。这种化合物在人肾细胞、肾脏类器官(患者细胞经改造后在培养皿中产生的微型肾脏)和MKD动物模型中起作用。BRD4780可能是开发治疗MKD和其他毒性蛋白病的新药物的起点。不过就目前而言,人们尚没有针对这些毒性蛋白病的治疗方法。
论文通讯作者、哈佛医学院副教授、布罗德研究所肾病计划主任、布莱根妇女医院肾脏专家Anna Greka说道,“我想到的是在研究MKD致病机制的过程中,我们发现了关于细胞如何处理错误折叠蛋白的迷人的新生物学特性,这些关键的新见解可能有助于我们解决几种破坏性疾病。我们的研究团队正在全天候工作,旨在将这些发现转化为我们能够尽快为患者带来的新疗法。”
3.Cell:挑战常规!延缓代谢可阻止有害的基因突变
doi:10.1016/j.cell.2019.06.023
在一项新的研究中,来自美国西北大学的研究人员发现将突变果蝇的代谢率降低50%,它们携带的很多突变的预期有害影响就从未表现出来。在通过实验测试这些果蝇的许多不同基因突变后,他们每次都发现了相同的结果。相关研究结果于2019年7月25日在线发表在Cell期刊上,论文标题为“Repressive Gene Regulation Synchronizes Development with Cellular Metabolism”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.06.023。
论文共同通讯作者、在西北大学领导实验研究的Richard Carthew说道,“当这些突变果蝇以正常的代谢率发育时,发育问题就出现。当我们降低它们的代谢率时,发育问题就会消失。它们发育得更慢,生长得更慢,但是它们是正常的动物。”
论文共同通讯作者、在西北大学领导计算研究的Luís Amaral补充道,“这推翻了我们所知道的关于发育的一切模式。我们总是认为如果‘破坏’了一些基因,那么这就会产生严重的发育后果。事实证实对于某些基因来说,这是不正确的---只要你也延缓了生长中的有机体的代谢。”
4.Cell:研究揭示了侵袭性脑癌很难治疗的原因
doi:10.1016/j.cell.2019.06.024
胶质母细胞瘤是一种无法治愈的脑癌,大多数患者在确诊后不到两年就会死亡。这种疾病很难治疗,主要是因为每种肿瘤都含有多种细胞。侵袭性脑癌在患者之间也有很大的差异,以至于研究人员争论是否应该将胶质母细胞瘤视为一种单一的疾病。一项新的研究可能有助于阐明是什么导致了这种重要的异质性,并使胶质母细胞瘤如此致命。
研究者对从20成人和8个儿科胶质母细胞瘤患者身上获得的超过24000多个肿瘤细胞及实验室胶质母细胞瘤模型进行了基因表达分析。他们发现胶质母细胞瘤细胞存在4个状态,每一个都有一个独特的基因表达程序,这些程序一起导致了肿瘤出现极大的变化。科学家们随后利用单细胞数据重新分析了癌症基因组图谱中的胶质母细胞瘤数据,并确定了与这四种状态相关的基因变化。
5.Cell:研究提出更好的减肥药!科学减肥指日可待!
doi:10.1016/j.cell.2019.05.048
有效的减肥策略要求吃更少的食物,燃烧更多的卡路里--或者理想情况下,两者兼而有之。但是,对于9000多万患有肥胖症的美国人来说,行为改变很难实现,或者效果不够,这就是为什么科学家们长期以来一直在寻找能够帮助人们减肥的药物。肥胖症会导致从癌症到心脏病等多种疾病。然而,到目前为止,有效、持久的治疗方法一直未能奏效。

图片来自Thomas Splettstoesser (Cell, 2019, doi10.1016/j.cell.2019.05.048
6、7.背靠背两篇Cell揭示肺癌转移新机制
doi:10.1016/j.cell.2019.06.005; doi:10.1016/j.cell.2019.06.020
瑞典和美国的研究人员在两项独立研究中报告说,肺癌细胞通过激活一种名为BACH1的蛋白质增加糖的摄取和使用,利用内源性或饮食中的抗氧化剂在体内扩散。这些发表在著名科学杂志《Cell》上的研究为新的肺癌治疗策略铺平了道路。
众所周知,癌细胞由于其特殊的代谢作用,会受到由自由基引起的氧化应激的影响。癌细胞的特征是高摄取和高利用葡萄糖,这是控制癌细胞分裂和转移能力的众多因素之一。通过对小鼠和人体组织的研究,两个独立的研究小组现在已经揭示了当癌细胞转移到身体其他部位时,这些环境是如何相互作用的。
当癌细胞减少氧化应激时,这个过程就开始了。氧化应激可以通过两种方式之一发生:癌细胞可以从饮食中获得抗氧化剂,如维生素A、C或E,或者合成它们自己的抗氧化剂。在大约三分之一的肺癌病例中,肿瘤细胞具有与NRF2和KEAP1基因相关的特殊突变,这些突变使它们能够开始产生自己的抗氧化剂。
当氧化应激消退时,新发现的基本过程就发生了: BACH1蛋白稳定下来,并在癌细胞中积累。这种蛋白质在癌细胞中按下几个启动按钮,从而刺激癌细胞的转移机制,包括一个命令癌细胞将葡萄糖代谢为细胞燃料和乳酸,并从血液中储存葡萄糖的机制。葡萄糖的使用速率越高,癌细胞扩散的能力就越强。
8.Cell:揭秘人类细胞如何对外部环境信号产生反应并加工处理
doi:10.1016/j.cell.2019.04.044
近日,一项刊登在国际杂志Cell上的研究报告中,来自海德堡大学等机构的科学家们通过研究利用新型的生物技术方法分析了人类细胞如何对外部信号产生反应并加工处理。文章中,研究者重点对G蛋白及其受体GPCRs之间的相互作用进行研究,G蛋白是信号传输的介导子,而GPCRs则会诱发信号过程。
研究者表示,他们不仅能够更好地理解GPCRs-G蛋白之间的相互作用,还能够有效预测这两者的功能。所有的有机体均能对来自环境中的外部信号产生反应,在人类和其它动物中,这些信号能被细胞膜中的受体(与G蛋白进行偶联)检测到并加工处理,GPCRs是最大的跨膜受体家族,其能对大量细胞外的物理化学信号产生反应,并诱发细胞中的特殊过程,其中一种方法就是与一种或多种G蛋白进行偶联,这项研究中,研究人员就对这些偶联过程进行了深入研究分析。
人类机体中拥有16种G蛋白,其能与近乎1000种GPCRs相互偶联,利用生物技术工具和机器学习手段,研究人员就能对148有代表的受体和11种蛋白进行深入研究来理解GPCRs-G蛋白之间的相互作用,随后研究者揭开了数百种GPCRs-G蛋白之间的偶联事件,这或许能够帮助理解GPCRs的工作机制。
9.Cell突破:发现抑制阿尔兹海默症蛋白聚集的通路
doi:10.1016/j.cell.2019.05.056
圣犹大儿童研究医院的科学家们发现了一种像洗车一样的方法,可以防止与阿尔兹海默症相关的有毒蛋白质的积聚。该报告于近日发表在《Cell》杂志上。
这项在小鼠阿尔兹海默症模型中进行的研究为治疗这种慢性神经退行性疾病提供了一个可能的新方法,它是美国的第六大死因。这种新发现的途径也有助于调节炎症,所以这项发现可能产生策略释放针对恶性脑瘤的免疫反应。

图片来源:Cell。
研究人员称这种途径为LC3相关的内吞作用或LANDO。他们在大脑和中枢神经系统的主要免疫细胞小胶质细胞中发现了这种途径。然而,初步证据表明,LANDO是一个在全身细胞都发挥功能的基本的过程。
研究人员发现LANDO可以防止老鼠的神经毒性β-淀粉样蛋白质沉淀。该通路的激活还可以预防毒性神经炎症和神经退化,包括记忆问题。
10.Cell:意外!太多维生素E等抗氧化剂反而会导致肺癌转移
doi:10.1016/j.cell.2019.06.003
一项新的研究解释了为什么肺癌在某些基因发生变化的患者中传播得更快,并表明长期以来被认为是预防措施的维生素E可能会导致同样的传播。由纽约大学医学院(NYU School of Medicine)和珀尔马特癌症中心(Perlmutter Cancer Center)的研究人员领导、在小鼠和人类组织中进行的实验揭示了BACH1蛋白与癌细胞迁移和组织侵袭之间的关系。
6月27日发表在《Cell》杂志上的这项研究结果反映了癌细胞的性质。癌细胞产生于一个地方,但经常扩散(转移)并在其他地方生根。肺癌转移是美国癌症死亡的主要原因。
"我们的结果最后阐明了BACH 1信号周围的网络机制,表明一类已批准的药物可以对抗约30%的癌症扩散的患者。"高级研究作者、医学博士Michele Pagano说道,他是纽约大学医学院的生物化学和分子药理学部门的主席。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


