非编码RNA之lncRNA研究进展(第3期)
来源:本站原创 2019-06-29 22:10
2019年6月29日讯/生物谷BIOON/---长链非编码RNA(long noncoding RNA,lncRNA)是一类不编码蛋白的RNA分子,长度在200bp以上;研究表明,lncRNA具有保守的二级结构,可以与蛋白、DNA和RNA相互作用,参与多种生物学过程的调控。国际著名的非编码RNA数据库NONCODE中显示,目前人类和小鼠的长非编码RNA基因的数目分别为56018和46475个。ln
2019年6月29日讯/生物谷BIOON/---长链非编码RNA(long noncoding RNA,lncRNA)是一类不编码蛋白的RNA分子,长度在200bp以上;研究表明,lncRNA具有保守的二级结构,可以与蛋白、DNA和RNA相互作用,参与多种生物学过程的调控。
国际著名的非编码RNA数据库NONCODE中显示,目前人类和小鼠的长非编码RNA基因的数目分别为56018和46475个。
lncRNA的表达水平相对于编码蛋白的基因一般比较低。多数lncRNA虽然不直接参与基因编码和蛋白质合成,但在基因组印记、染色质修饰、基因转录后调控、剪切和修饰等过程中发挥着非常重要的功能,也在很多生命活动中均起着举足轻重的作用。它们与疾病的发生发展、诊断治疗密切相关,迅速成为当今分子生物学最热门的前沿研究领域之一。另外,lncRNA的亚细胞位置上也呈多样化,在细胞核、细胞质和细胞器均有分布,甚至某些lncRNA具有独特的亚细胞位置,有可能是全新的亚细胞构成。
1.Nature:揭示哺乳动物器官中lncRNA在发育期间的动态变化
doi:10.1038/s41586-019-1341-x
在一项新的研究中,来自德国海德堡大学和瑞士洛桑大学的研究人员分析了来自7种物种(人类、恒河猴、小鼠、大鼠、兔子、负鼠和鸡)的7种主要器官在不同的发育时间点(从早期的器官发生到成年时)的lncRNA表达模式。他们的分析在每种物种中鉴定出大约15000~35000个候选lncRNA,其中的大多数显示出物种特异性。相关研究结果于2019年6月26日在线发表在Nature期刊上,论文标题为“Developmental dynamics of lncRNAs across mammalian organs and species”。
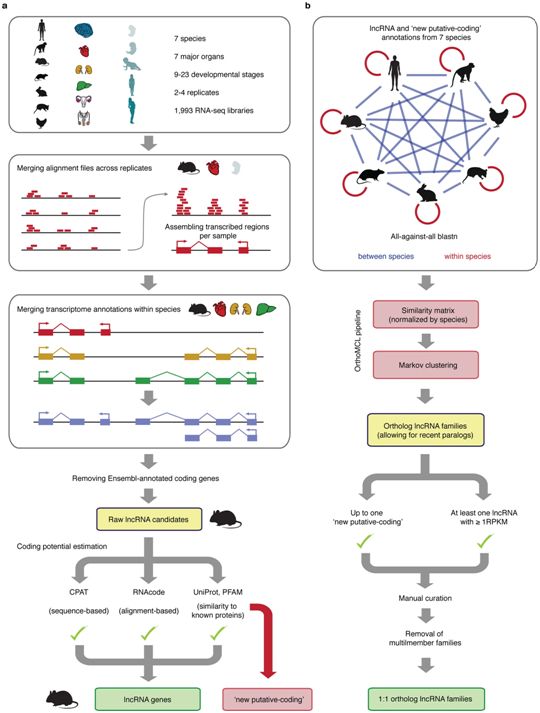
这些研究人员描述了lncRNA在不同发育阶段的表达模式,并发现许多随着时间的推移具有动态表达模式lncRNA表现出功能丰富的特征。他们还发现在发育期间,广泛表达的和保守的lncRNA向越来越多的谱系和器官特异性的lncRNA转变。
2.Nat Commun:发现治疗前列腺癌的关键分子开关
doi:10.1038/s41467-019-09784-9
威尔莫特癌症研究所的科学家们相信,他们已经找到了一种治疗晚期前列腺癌的常用药物在四五个月后常常失效的原因,这种药物似乎具有双重功能,后来会把癌症变成一个无情的侵略者。通讯作者Chawnshang Chang博士和他的同事描述了恩杂鲁胺(enzalutamide)是如何在不经意间引起有害的转化的,他们相信他们已经发现了一种阻止这种转化发生的方法,至少在老鼠身上是这样的。这项研究由罗切斯特大学生物系的研究生Jie Luo领导,发表在《Nature Communications》杂志上。
对于患有去势抵抗性前列腺癌且不再对化疗有反应的男性来说,恩杂鲁胺可以将生存期平均延长5个月。2018年,FDA还批准了这种药物用于治疗尚未扩散的去势抵抗性前列腺癌患者。但是恩杂鲁胺会引起副作用。最糟糕的影响之一是神经内分泌分化(NED),即前列腺肿瘤中神经内分泌细胞的增加。大量的NED细胞使肿瘤对治疗产生抗药性。
Chang和Luo发现非编码RNA-p21是诱导神经内分泌分化的主要原因,因为IncRNAp-21可以改变关键基因EZH2的功能。他们还表明IncRNAp-21在NED前列腺肿瘤中高表达。尽管目前还没有临床试验可以阻断分子开关,但Chang的实验室已经发现了一种小分子药物,这种药物似乎对小鼠有效;其他地方的研究人员也发现了类似的药物,但还需要进一步的研究。
3.PNAS:驱动HIV存储库细胞自我毁灭有望开发出新型HIV疗法
doi:10.1073/pnas.1818662116
尽管当前的HIV疗法能够成功控制病毒的活动性感染,但HIV能在组织储存库(包括巨噬细胞)中长久存活,而这很显然是一个持久性的问题;近日一项刊登在国际杂志PNAS上的研究报告中,来自康乃尔大学的科学家们通过研究找到了一个攻击HIV的新方向,其或能在不影响机体健康细胞的情况下,有选择性地清除HIV病毒储存库细胞。

文章中,研究者描述了名为SAF的遗传调节子如何帮助HIV感染的巨噬细胞免于细胞死亡的,当阻断感染HIV的细胞中SAF的功能时,研究者发现,这些病毒储存库细胞会自我破坏,研究者对这些细胞死亡的特异性感到非常惊讶,只有受感染的细胞会发生死亡,而处于相同剂量及相同疗法的旁观者细胞则不会完全死亡。
这项研究中,研究人员想通过研究调查哪些细胞机制能够帮助维持受感染的巨噬细胞存活,随后他们将注意力转移到了对长链非编码RNAs (lncRNAs)进行研究,这类遗传编码元件能帮助开启或关闭基因表达,但并不会直接翻译为蛋白质;研究者非常感兴趣研究lncRNAs,因为其是细胞通路的主要调节子,而且并未对HIV感染进行系统性地研究。研究人员对三类不同的人类巨噬细胞中90个具有特性的lncRNAs进行筛选研究,这三类巨噬细胞包括健康细胞、HIV感染细胞、旁观者细胞(bystander cells),旁观者细胞是暴露于HIV但并未受到感染的细胞。
研究者发现,在HIV感染的巨噬细胞中,名为SAF的lncRNA明显被上调了,而且此前研究结果表明,SAF能抑制细胞凋亡;因此研究者推测,SAF或能保护HIV感染的巨噬细胞免于死亡。为了证实这一猜测,研究者利用siRNA(小型感染RNA)阻断了SAF的功能,siRNA能选择性地降解RNAs(比如SAF),随后研究者在上述三类细胞中沉默了SAF的表达,结果发现,HIV感染的细胞会突然发生自我毁灭,而健康细胞和旁观者细胞则并不会受到影响。
4.Cell Rep:癌细胞通过微小囊泡选择性地输出多种类型的长链RNA
doi:10.1016/j.celrep.2018.09.054
在一项新的研究中,美国范德堡大学的James G. Patton博士及其同事们研究了结直肠癌细胞如何能够以一种受到严格调节的方式分泌长链RNA。相关研究结果发表在2018年10月16日的Cell Reports期刊上,论文标题为“Diverse Long RNAs Are Differentially Sorted into Extracellular Vesicles Secreted by Colorectal Cancer Cells”。
这些作者之前已展示了分泌的短链RNA如何有助于其他的癌细胞生长和扩散。在这项新的研究中,他们证实结直肠癌细胞能够以特定的方式分泌编码蛋白的长链RNA或者不编码蛋白的长链RNA(lncRNA)。
在KRAS基因发生突变的结直肠癌细胞中,许多分泌的微小囊泡将编码Rab13蛋白的mRNA递送给新细胞。Rab13可能在调节微小囊泡分泌哪些RNA中发挥作用,此外它也经常在抵抗放射治疗的细胞中发现到,因此它可能有助于让癌细胞更具侵袭性。
最后,在结直肠癌细胞以微小囊泡的形式分泌RNA并将它们递送给新细胞的过程中,为了检测长链RNA的功能性转移,这些作者利用基于CRISPR/Cas9的RNA追踪系统监测了长链RNA到新细胞的递送。他们证实含有来自分泌的长链RNA的输出信号的向导RNA(gRNA)能够从分泌这些长链RNA的细胞转移动接受它们的新细胞中。这些数据支持癌细胞通过一种新的细胞机制选择性输出多种类型的长链RNA。
5.Cell Death&Disease:lncRNA结合miRNA促进结肠癌增殖和转移
doi:10.1038/s41419-018-0759-7
越来越多的证据表明长非编码RNA在癌症进展过程中发挥重要作用,但是关于lncRNA SNHG7在结直肠癌中的研究仍然较少,该分子如何参与结直肠癌进展仍然不清楚。来自大连医科大学的研究人员对lncRNA SNHG7在结直肠癌中发挥的作用进行了研究,相关研究结果发表在国际学术期刊Cell Death & Disease上。
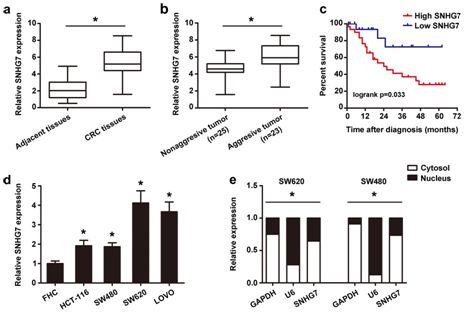
在这项研究中,研究人员发现SNHG7的表达在结直肠癌组织中显著上调,特别是在一些恶性程度更高的病例中。与之相一致的是,SNHG7在结直肠癌细胞系中的表达水平也显著高于正常的结肠细胞。研究结果进一步表明,SNHG7的过表达能够促进结直肠癌细胞的增殖,迁移和侵袭,而在缺少SNHG7的情况下癌细胞的侵袭和存活能力受到显著抑制。
研究人员发现敲低SNHG7能够抑制GALNT1和上皮间充质转化标志物(E-cadherin和Vimentin)的表达,更为重要的是,他们发现SNHG7能够与miR-216b直接结合,miR-216b的下调可以有效逆转SNHG7敲低诱导的对GALNT1的抑制。除此之外,过表达SNHG7还可以显著增强SW480细胞在体内的肿瘤形成能力和肝脏转移能力。SNHG7能够通过结合miR-216b正向调节GALNT1的水平,在结直肠癌的进展过程中发挥癌基因作用。
6.Cancer Res:清华大学学者揭示lncRNA促进前列腺癌新机制
doi:10.1158/0008-5472.CAN-18-0688
长链非编码RNA(lncRNA)是长度大于200nt不编码蛋白质的RNA,起初认为lncRNA是基因组转录的“噪音”,不具有生物学功能,但近年来研究表明lncRNA参与染色体沉默、染色质修饰、转录激活和转录干扰等多种功能。长非编码RNA NEAT1(nuclear enriched abundant transcript 1)能够调节多种癌症相关的细胞活动,包括细胞增殖,凋亡和迁移,但与前列腺癌的关系仍然没有得到深入的了解。
在一项新的研究中,来自清华大学的研究人员证实抑制NEAT1能够诱导DNA损伤,干扰细胞周期并使前列腺癌细胞的增殖发生暂停。他们首先对TCGA(The Cancer Genome Atlas)的前列腺癌肿瘤转录组数据进行挖掘,发现了一系列转录因子对靶基因的调控活性都依赖于NEAT1的表达水平。
CDC5L是其中一个转录因子,能够与NEAT1直接结合。研究人员发现在前列腺癌细胞中沉默NEAT1能够抑制CDC5L的转录活性,RNA-seq和ChIP-seq的分析结果进一步揭示了许多受CDC5L调控的潜在靶点,都受NEAT1表达水平的影响。其中一个靶点——ARGN,能够介导NEAT1表达水平下降后产生的强烈表型,包括DNA损伤,细胞周期紊乱以及增殖过程的暂停。
7.Hepatology:乙肝病毒上调LncRNA促进肝脏肿瘤发生
doi:10.1002/hep.30098
最近一些研究表明许多lncRNA在肝细胞癌中出现失调,lncRNA的异常表达与肿瘤发生和不良预后都存在相关性。为了发现H乙型肝炎病毒(HBV)相关的lncRNA,来自中国科学院微生物研究所的研究人员使用RNA深度测序对HepG2细胞和HBV转基因的HepG2-4D14细胞的lncRNA的丰度进行量化,他们发现lnc-HUR1在HepG2-4D14细胞中显著上调并对其功能和机制进行了深入研究。相关研究结果发表在国际学术期刊Hepatology上。
研究人员发现HBV编码的HBx能够增强lnc-HUR1的转录,过表达lnc-HUR1能够促进细胞增殖,而敲低lnc-HUR1则会抑制细胞生长。进一步的机制研究表明lnc-HUR1能够与p53发生相互作用并抑制其对下游基因的转录调控,比如p21和Bax。研究人员构建了lnc-HUR1转基因小鼠并进行肝脏部分切除以检测肝脏的再生能力,结果表明在切除后2天和3天进行检测,发现lnc-HUR1转基因小鼠的肝脏/体重比例比野生型小鼠更高,并且BrdU染色结果也表明lnc-HUR1转基因小鼠的BrdU阳性细胞比例显著高于野生型小鼠,提示lnc-HUR1能够在肝再生过程中促进细胞增殖。
研究人员还进行了DEN诱导肝肿瘤实验,结果证明lnc-HUR1转基因小鼠的肿瘤数目也高于对照小鼠,表明lnc-HUR1能够增强DEN诱导的肿瘤发生过程。
8.Oncogene:南京医科大学学者发现促进胃癌进展的重要lncRNA
doi:10.1038/s41388-018-0308-y
来自南京医科大学第一附属医院的束永前等人对在胃癌中发挥重要调控作用的lncRNA进行了深入分析,并对FOXD2-AS1在胃癌进展中发挥的功能以及调控的相关生物学机制进行了深入了解。相关研究结果发表在国际学术期刊Oncogene上。
研究人员通过深度分析发现FOXD2-AS1在胃癌中显著上调并且与肿瘤大小,癌症发展阶段和不良预后存在正相关关系。他们又对GEO数据库进行基因富集分析,结果表明与细胞周期和DNA复制相关的基因在FOXD2-AS1高表达的病人中存在显著富集。功能研究表明FOXD2-AS1功能缺失能够通过抑制胃癌细胞的细胞周期进程抑制细胞生长,而FOXD2-AS1的表达上调能够促进癌症进展。
进一步的研究表明甲基转移酶EZH2和去甲基化酶LSD1能够与FOXD2-AS1结合并可以对其进行功能的调节。从机制上来说,FOXD-AS1通过EZH2和LSD1介导EphB3下调促进胃癌发生。这些结果表明在胃癌发生过程中FOXD2-AS1可以通过与EZH2和LSD1发生直接相互作用抑制EphB3发挥肿瘤诱导因子的作用,因此该分子或可成为检测癌症发生的新标志物。
9.Cell:开发出基于CRISPR的方法研究lncRNA的功能
doi:10.1016/j.cell.2018.03.052
如今,在一项开创性的研究中,来自美国贝丝以色列女执事医学中心等研究机构的研究人员开发出一种新方法来鉴定和确定lncRNA在急性髓细胞白血病(AML)对化疗药物产生耐药性中所起的功能作用。这种新技术将来自公开可获得的药理学数据库的信息与前沿的CRISPR技术相结合,筛选影响治疗反应的编码基因和非编码基因。总而言之,这种全基因组筛查平台可用于鉴定和确定与许多健康情况相关的lncRNA的功能。相关研究结果发表在2018年4月19日的Cell期刊上,论文标题为“An Integrated Genome-wide CRISPRa approach to Functionalize lncRNAs in Drug Resistance”。论文通信作者为贝丝以色列女执事医学中心的Pier Paolo Pandolfi教授。
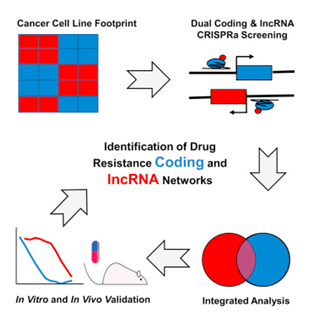
Pandolfi和同事们着重关注控制阿糖胞苷(Cytarabine, Ara-C)耐药性的遗传学特征。阿糖胞苷是治疗AML的一种金标准化疗药物,然而30%~50%的AML患者会产生耐药性。在这项多步骤研究的第一阶段,这些研究人员将来自两个公开可获得的数据库---癌症靶点发现与开发(Cancer Target Discovery and Development)数据库和癌细胞系百科全书(Cancer Cell Line Encyclopedia)数据库---的信息进行交叉参考,以便鉴定出似乎与760种不同的细胞系对阿糖胞苷的敏感性和耐药性相关的基因。
论文第一作者、Pandolfi实验室博士后研究员Assaf Bester博士说,“我们已知道哪些细胞系对这种药物敏感,哪些细胞对它不敏感。通过研究哪些基因可能在敏感性的细胞系和耐药性的细胞系中偏好地表达或受到抑制,我们能够预测哪些基因会促进耐药性产生。我们也可通过查看AML患者反应率数据来寻找可能与较差的存活率相关的基因。”
Pandolfi说,“如果我告诉你某个基因参与介导化疗药物耐药性,那么你可开展文献检索,找出关于这个基因的一些已知的信息,并提出你自己的假设。不过就非编码基因而言,没有什么文献可进行搜索。它们都是新的基因,而且我们仅是不知道它们发挥何种功能---它们的功能并未被描述过。”
为此,Pandolfi和同事们将生物信息学研究工作转移到体内测试。他们进行基于CRISPR的高通量筛选,以便独立地评估哪些基因可能决定着阿糖胞苷耐药性。这种CRISPR技术允许这些研究人员一次分析成千上万个编码基因和lncRNA,并可激活感兴趣的基因。这些研究人员随后利用阿糖胞苷处理细胞来观察这些基因如何作出反应。基因富集的丧失表明它在药物敏感性中发挥作用; 增强的基因富集意味着它介导耐药性。
10.Nat Commun:基于RNA分子的新型疗法有望治疗肺癌
doi:10.1038/s41467-018-03265-1
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自瑞典的科学家们表示,通过降低特殊RNA分子的活性就能使得小鼠肺部肿瘤缩小40%至50%,这或许是研究中的冰山一角,此外研究人员还从14类不同癌症中鉴别出了633个新型的生物标志物。
文章中,研究人员阐明了长链非编码RNA分子如何影响机体肿瘤的发育,这些分子是此前被分类为垃圾DNA的基因组中的一部分所产生的,研究人员发现这些RNA分子能够调节细胞分裂的能力。目前支持这项研究结果的证据是非常广泛的,研究人员对16种不同类型的癌症进行研究,其中包括6419份实体瘤,同时以701份正常组织为对照进行研究,研究人员的目的在于鉴别在细胞分裂期间处于活性状态的长链非编码RNA分子。
利用一种内部开发的新技术及现代的RNA测序技术,研究人员鉴别出了570个长链非编码RNA分子,依赖于不同的癌症类型这些RNA分子会进行不同程度地表达,同时研究者还发现,利用633种新型独立生物标志物就能预测和治疗14种类型的癌症,相关研究结果对于全球各地的癌症研究人员都非常重要。
11.PNAS:供血不足?请找lncRNAs帮助血管生长!
doi:10.1073/pnas.1715182115
一项近日发表的新研究发现一个新发现的基因可以在感受到组织血流不足的情况下帮助长出新血管。这项研究发表在《PNAS》上,由圣迈克尔医院生物医学科学研究中心的Philip Marsden博士及其实验室研究者Jeffrey Man博士领导完成。
Marsden博士实验室主要研究内皮细胞——围在血管壁内的一层细胞。在这项研究中,他们研究了一组新的基因——长非编码RNAs(lncRNAs)。所有细胞中都有RNA,传统观点认为它的主要工作是携带DNA信息翻译成蛋白质。但是lncRNAs有其他的功能,包括决定单个细胞在器官中扮演的最终角色。研究lncRNA给予了研究人员新机会找出可以帮助病人诊断的新的生物标记物和测试。
Man博士说,这项研究是第一次发现哪些lncRNAs在内皮细胞中更丰富。他们计划将这些信息公开,供给其他研究人员使用。
随后他们发现其中一个lncRNAs——STEEL负责感受微血管中的血流供应。Man说道,“很有趣的是STEEL帮助我们的身体对血供不足产生反应,会帮助长出更多的新血管。这些结果表明我们的身体就像我们需要的一样具有很优异的调节功能,同时也表明扰乱这种平衡会造成疾病。这些数据将进一步帮助我们加深对血管疾病的认识,并帮助我们找到改善伤后修复的方法。”
12.Nat Med:新研究发现无用的自私基因可以预防心脏病!
doi:10.1038/nm.4479
科学家们已经发现了一个基因,可能在预防心脏病中发挥重要保护作用。他们的研究发现基因MeXis在动脉栓塞组织中的关键细胞内帮助清除来自血管的过量胆固醇。这项研究发表在《Nature Medicine》上,由UCLA领导的研究团队在小鼠实验中发现MeXis控制着一个关键蛋白的表达,该蛋白可以将动脉血管壁上细胞内的胆固醇泵出细胞。
MeXis是自私基因的一个范例,自私基因是指一类不会产生蛋白因此被认为没有功能的基因。然而近年来的研究发现尽管这类无用的基因不会产生蛋白质,但是它们可以通过产生长非编码RNAs(lncRNAs)发挥重要的生物学功能。
“这项研究告诉我们lncRNAs对于涉及心脏病发展的细胞的内部功能很重要。”该研究通讯作者、UCLA大卫格芬医学院病理学和实验医学Frances and Albert Piansky教授Peter Tontonoz博士说道。“考虑到许多和MeXis一样的基因具有完全未知的功能,我们的研究表明进一步探索其他lncRNAs如何发挥功能将为正常生理学及疾病带来新的认识。”
在这项研究中,研究人员发现缺失MeXis的小鼠血管堵塞的概率是正常小鼠的两倍。此外,增加MeXis表达可以使细胞更有效地清除过量胆固醇。
13.Diabetes:北大学者发现影响肝脏糖脂代谢的新lncRNA
doi:10.2337/db17-0799
RNA不仅承担遗传信息中间载体的角色,还承担着各种调控功能,长非编码RNA(LncRNA)在发育和基因表达中发挥着复杂精确的调控功能。哺乳动物的基因组能够编码许多LncRNA但大部分LncRNA的功能仍然未知。最近一项研究发现了一个新的LncRNA在调节肝脏糖/脂质代谢方面的作用和机制,这个LncRNA叫做LncSHGL(LncRNA Suppressor of Hepatic Gluconeogenesis and Lipogenesis)。相关研究结果发表在国际学术期刊Diabetes上。
在这项研究中,研究人员发现在肥胖小鼠和非酒精性脂肪肝病人的肝脏中小鼠LncSHGL及其人类同源分子LncRNA B4GALT1-AS1的表达水平都存在下降。重新恢复肥胖糖尿病小鼠肝脏中LncSHGL的水平能够使高血糖症、胰岛素抵抗和肝脏脂肪变性得到改善,抑制肝脏LncSHGL能够促使正常小鼠出现高血糖症和肝脏脂肪沉积。在肥胖小鼠肝脏中过表达LncSHGL还可以增加Akt磷酸化水平,抑制糖异生和脂肪合成基因的表达,而在正常小鼠肝脏中抑制LncSHGL表达则表现出相反的表型。
从机制上来说,研究人员发现LncSHGL招募hnRNPA1来增强CALM mRNA的翻译效率增加CaM蛋白水平,不影响其转录,这会导致PI3K/Akt信号途径的激活抑制mTOR/SREBP-1c途径,并且不依赖肝脏细胞中的胰岛素和钙信号。肝脏中过表达hnRNPA1也会激活CaM/Akt信号途径,抑制mTOR/SREBP-1c途径改善肥胖小鼠的高血糖症和肝脏脂肪变性。
14.Nat Commun:神技能!仅通过操控单一RNA分子就足以逆转机体细胞衰老!
doi:10.1038/s41467-017-01921-6
近日,一篇发表在国际杂志Nature Communications上的研究报告中,来自葡萄牙里斯本大学的研究人员通过研究发现,通过操控单一的RNA分子就足以逆转细胞衰老。
核糖核酸分子(RNA分子)主要负责细胞中蛋白质的产生,然而一类名为非编码RNA的特殊RNA分子却并不会翻译成为蛋白质分子,实际上,从2001年科学家们开始对人类基因组进行图谱绘制时,他们就知道人类基因组中实际上仅有大约2%的RNA会被翻译成为蛋白质。
如今在这项最新研究中,研究人员Bruno de Jesus及其同事利用遗传修饰的小鼠模型来研究细胞老化和再生的过程,他们发现,相比年轻小鼠的细胞而言,衍生自老年小鼠机体皮肤的细胞能够产生大量名为Zeb2-NAT的长链非编码RNA分子,通过降低机体中这类特殊RNA分子的水平,研究人员或许就有望有效再生老化的细胞。
15.Cell:新突破!抑制THOR表达有望阻止癌症产生
doi:10.1016/j.cell.2017.11.040
在一项新的研究中,来自美国密歇根大学综合癌症中心的研究人员在研究人基因组中之前未被探究的区域---人基因组中的暗物质,或者说非编码的DNA序列---时,发现了一个他们称之为THOR的新基因。相关研究结果发表在2017年12月14日的Cell期刊上,论文标题为“Oncogenic Role of THOR, a Conserved Cancer/Testis Long Non-coding RNA”。
这些研究人员描述了一种在人类、小鼠和斑马鱼中表达的长链非编码RNA(lncRNA)。不同寻常的是,这种类型的RNA在整个物种中是保守的。他们的想法是如果lncRNA在除人类之外的动物物种中发挥作用,那么它必须是比较重要的。
论文通信作者、密歇根大学病理学教授、密歇根大学密歇根转化病理学中心主任Arul Chinnaiyan博士说,“进化上保守的基因对生物学过程可能是比较重要的。我们发现THOR是一个高度保守的lncRNA的事实是激动人心的。鉴于我们认为它经过进化选择而具有重要的功能,我们选择着重关注它。”
事实上,这些研究人员发现这种特定的lncRNA在癌症产生中发挥着作用。通过基因手段将它敲除能够阻止肿瘤生长。这是首次鉴定出和描述THOR。THOR的全称是睾丸相关的高度保守的致癌性lncRNA(Testis-associated Highly-conserved Oncogenic long non-coding RNA)。(生物谷 Bioon.com)
国际著名的非编码RNA数据库NONCODE中显示,目前人类和小鼠的长非编码RNA基因的数目分别为56018和46475个。
lncRNA的表达水平相对于编码蛋白的基因一般比较低。多数lncRNA虽然不直接参与基因编码和蛋白质合成,但在基因组印记、染色质修饰、基因转录后调控、剪切和修饰等过程中发挥着非常重要的功能,也在很多生命活动中均起着举足轻重的作用。它们与疾病的发生发展、诊断治疗密切相关,迅速成为当今分子生物学最热门的前沿研究领域之一。另外,lncRNA的亚细胞位置上也呈多样化,在细胞核、细胞质和细胞器均有分布,甚至某些lncRNA具有独特的亚细胞位置,有可能是全新的亚细胞构成。
1.Nature:揭示哺乳动物器官中lncRNA在发育期间的动态变化
doi:10.1038/s41586-019-1341-x
在一项新的研究中,来自德国海德堡大学和瑞士洛桑大学的研究人员分析了来自7种物种(人类、恒河猴、小鼠、大鼠、兔子、负鼠和鸡)的7种主要器官在不同的发育时间点(从早期的器官发生到成年时)的lncRNA表达模式。他们的分析在每种物种中鉴定出大约15000~35000个候选lncRNA,其中的大多数显示出物种特异性。相关研究结果于2019年6月26日在线发表在Nature期刊上,论文标题为“Developmental dynamics of lncRNAs across mammalian organs and species”。

图片来自Nature, 2019, doi:10.1038/s41586-019-1341-x。
这些研究人员描述了lncRNA在不同发育阶段的表达模式,并发现许多随着时间的推移具有动态表达模式lncRNA表现出功能丰富的特征。他们还发现在发育期间,广泛表达的和保守的lncRNA向越来越多的谱系和器官特异性的lncRNA转变。
2.Nat Commun:发现治疗前列腺癌的关键分子开关
doi:10.1038/s41467-019-09784-9
威尔莫特癌症研究所的科学家们相信,他们已经找到了一种治疗晚期前列腺癌的常用药物在四五个月后常常失效的原因,这种药物似乎具有双重功能,后来会把癌症变成一个无情的侵略者。通讯作者Chawnshang Chang博士和他的同事描述了恩杂鲁胺(enzalutamide)是如何在不经意间引起有害的转化的,他们相信他们已经发现了一种阻止这种转化发生的方法,至少在老鼠身上是这样的。这项研究由罗切斯特大学生物系的研究生Jie Luo领导,发表在《Nature Communications》杂志上。
对于患有去势抵抗性前列腺癌且不再对化疗有反应的男性来说,恩杂鲁胺可以将生存期平均延长5个月。2018年,FDA还批准了这种药物用于治疗尚未扩散的去势抵抗性前列腺癌患者。但是恩杂鲁胺会引起副作用。最糟糕的影响之一是神经内分泌分化(NED),即前列腺肿瘤中神经内分泌细胞的增加。大量的NED细胞使肿瘤对治疗产生抗药性。
Chang和Luo发现非编码RNA-p21是诱导神经内分泌分化的主要原因,因为IncRNAp-21可以改变关键基因EZH2的功能。他们还表明IncRNAp-21在NED前列腺肿瘤中高表达。尽管目前还没有临床试验可以阻断分子开关,但Chang的实验室已经发现了一种小分子药物,这种药物似乎对小鼠有效;其他地方的研究人员也发现了类似的药物,但还需要进一步的研究。
3.PNAS:驱动HIV存储库细胞自我毁灭有望开发出新型HIV疗法
doi:10.1073/pnas.1818662116
尽管当前的HIV疗法能够成功控制病毒的活动性感染,但HIV能在组织储存库(包括巨噬细胞)中长久存活,而这很显然是一个持久性的问题;近日一项刊登在国际杂志PNAS上的研究报告中,来自康乃尔大学的科学家们通过研究找到了一个攻击HIV的新方向,其或能在不影响机体健康细胞的情况下,有选择性地清除HIV病毒储存库细胞。

图片来自图片来源:NIAID。
文章中,研究者描述了名为SAF的遗传调节子如何帮助HIV感染的巨噬细胞免于细胞死亡的,当阻断感染HIV的细胞中SAF的功能时,研究者发现,这些病毒储存库细胞会自我破坏,研究者对这些细胞死亡的特异性感到非常惊讶,只有受感染的细胞会发生死亡,而处于相同剂量及相同疗法的旁观者细胞则不会完全死亡。
这项研究中,研究人员想通过研究调查哪些细胞机制能够帮助维持受感染的巨噬细胞存活,随后他们将注意力转移到了对长链非编码RNAs (lncRNAs)进行研究,这类遗传编码元件能帮助开启或关闭基因表达,但并不会直接翻译为蛋白质;研究者非常感兴趣研究lncRNAs,因为其是细胞通路的主要调节子,而且并未对HIV感染进行系统性地研究。研究人员对三类不同的人类巨噬细胞中90个具有特性的lncRNAs进行筛选研究,这三类巨噬细胞包括健康细胞、HIV感染细胞、旁观者细胞(bystander cells),旁观者细胞是暴露于HIV但并未受到感染的细胞。
研究者发现,在HIV感染的巨噬细胞中,名为SAF的lncRNA明显被上调了,而且此前研究结果表明,SAF能抑制细胞凋亡;因此研究者推测,SAF或能保护HIV感染的巨噬细胞免于死亡。为了证实这一猜测,研究者利用siRNA(小型感染RNA)阻断了SAF的功能,siRNA能选择性地降解RNAs(比如SAF),随后研究者在上述三类细胞中沉默了SAF的表达,结果发现,HIV感染的细胞会突然发生自我毁灭,而健康细胞和旁观者细胞则并不会受到影响。
4.Cell Rep:癌细胞通过微小囊泡选择性地输出多种类型的长链RNA
doi:10.1016/j.celrep.2018.09.054
在一项新的研究中,美国范德堡大学的James G. Patton博士及其同事们研究了结直肠癌细胞如何能够以一种受到严格调节的方式分泌长链RNA。相关研究结果发表在2018年10月16日的Cell Reports期刊上,论文标题为“Diverse Long RNAs Are Differentially Sorted into Extracellular Vesicles Secreted by Colorectal Cancer Cells”。
这些作者之前已展示了分泌的短链RNA如何有助于其他的癌细胞生长和扩散。在这项新的研究中,他们证实结直肠癌细胞能够以特定的方式分泌编码蛋白的长链RNA或者不编码蛋白的长链RNA(lncRNA)。
在KRAS基因发生突变的结直肠癌细胞中,许多分泌的微小囊泡将编码Rab13蛋白的mRNA递送给新细胞。Rab13可能在调节微小囊泡分泌哪些RNA中发挥作用,此外它也经常在抵抗放射治疗的细胞中发现到,因此它可能有助于让癌细胞更具侵袭性。
最后,在结直肠癌细胞以微小囊泡的形式分泌RNA并将它们递送给新细胞的过程中,为了检测长链RNA的功能性转移,这些作者利用基于CRISPR/Cas9的RNA追踪系统监测了长链RNA到新细胞的递送。他们证实含有来自分泌的长链RNA的输出信号的向导RNA(gRNA)能够从分泌这些长链RNA的细胞转移动接受它们的新细胞中。这些数据支持癌细胞通过一种新的细胞机制选择性输出多种类型的长链RNA。
5.Cell Death&Disease:lncRNA结合miRNA促进结肠癌增殖和转移
doi:10.1038/s41419-018-0759-7
越来越多的证据表明长非编码RNA在癌症进展过程中发挥重要作用,但是关于lncRNA SNHG7在结直肠癌中的研究仍然较少,该分子如何参与结直肠癌进展仍然不清楚。来自大连医科大学的研究人员对lncRNA SNHG7在结直肠癌中发挥的作用进行了研究,相关研究结果发表在国际学术期刊Cell Death & Disease上。

图片来自Cell Death & Disease, 2018, doi:10.1038/s41419-018-0759-7。
在这项研究中,研究人员发现SNHG7的表达在结直肠癌组织中显著上调,特别是在一些恶性程度更高的病例中。与之相一致的是,SNHG7在结直肠癌细胞系中的表达水平也显著高于正常的结肠细胞。研究结果进一步表明,SNHG7的过表达能够促进结直肠癌细胞的增殖,迁移和侵袭,而在缺少SNHG7的情况下癌细胞的侵袭和存活能力受到显著抑制。
研究人员发现敲低SNHG7能够抑制GALNT1和上皮间充质转化标志物(E-cadherin和Vimentin)的表达,更为重要的是,他们发现SNHG7能够与miR-216b直接结合,miR-216b的下调可以有效逆转SNHG7敲低诱导的对GALNT1的抑制。除此之外,过表达SNHG7还可以显著增强SW480细胞在体内的肿瘤形成能力和肝脏转移能力。SNHG7能够通过结合miR-216b正向调节GALNT1的水平,在结直肠癌的进展过程中发挥癌基因作用。
6.Cancer Res:清华大学学者揭示lncRNA促进前列腺癌新机制
doi:10.1158/0008-5472.CAN-18-0688
长链非编码RNA(lncRNA)是长度大于200nt不编码蛋白质的RNA,起初认为lncRNA是基因组转录的“噪音”,不具有生物学功能,但近年来研究表明lncRNA参与染色体沉默、染色质修饰、转录激活和转录干扰等多种功能。长非编码RNA NEAT1(nuclear enriched abundant transcript 1)能够调节多种癌症相关的细胞活动,包括细胞增殖,凋亡和迁移,但与前列腺癌的关系仍然没有得到深入的了解。
在一项新的研究中,来自清华大学的研究人员证实抑制NEAT1能够诱导DNA损伤,干扰细胞周期并使前列腺癌细胞的增殖发生暂停。他们首先对TCGA(The Cancer Genome Atlas)的前列腺癌肿瘤转录组数据进行挖掘,发现了一系列转录因子对靶基因的调控活性都依赖于NEAT1的表达水平。
CDC5L是其中一个转录因子,能够与NEAT1直接结合。研究人员发现在前列腺癌细胞中沉默NEAT1能够抑制CDC5L的转录活性,RNA-seq和ChIP-seq的分析结果进一步揭示了许多受CDC5L调控的潜在靶点,都受NEAT1表达水平的影响。其中一个靶点——ARGN,能够介导NEAT1表达水平下降后产生的强烈表型,包括DNA损伤,细胞周期紊乱以及增殖过程的暂停。
7.Hepatology:乙肝病毒上调LncRNA促进肝脏肿瘤发生
doi:10.1002/hep.30098
最近一些研究表明许多lncRNA在肝细胞癌中出现失调,lncRNA的异常表达与肿瘤发生和不良预后都存在相关性。为了发现H乙型肝炎病毒(HBV)相关的lncRNA,来自中国科学院微生物研究所的研究人员使用RNA深度测序对HepG2细胞和HBV转基因的HepG2-4D14细胞的lncRNA的丰度进行量化,他们发现lnc-HUR1在HepG2-4D14细胞中显著上调并对其功能和机制进行了深入研究。相关研究结果发表在国际学术期刊Hepatology上。

研究人员发现HBV编码的HBx能够增强lnc-HUR1的转录,过表达lnc-HUR1能够促进细胞增殖,而敲低lnc-HUR1则会抑制细胞生长。进一步的机制研究表明lnc-HUR1能够与p53发生相互作用并抑制其对下游基因的转录调控,比如p21和Bax。研究人员构建了lnc-HUR1转基因小鼠并进行肝脏部分切除以检测肝脏的再生能力,结果表明在切除后2天和3天进行检测,发现lnc-HUR1转基因小鼠的肝脏/体重比例比野生型小鼠更高,并且BrdU染色结果也表明lnc-HUR1转基因小鼠的BrdU阳性细胞比例显著高于野生型小鼠,提示lnc-HUR1能够在肝再生过程中促进细胞增殖。
研究人员还进行了DEN诱导肝肿瘤实验,结果证明lnc-HUR1转基因小鼠的肿瘤数目也高于对照小鼠,表明lnc-HUR1能够增强DEN诱导的肿瘤发生过程。
8.Oncogene:南京医科大学学者发现促进胃癌进展的重要lncRNA
doi:10.1038/s41388-018-0308-y
来自南京医科大学第一附属医院的束永前等人对在胃癌中发挥重要调控作用的lncRNA进行了深入分析,并对FOXD2-AS1在胃癌进展中发挥的功能以及调控的相关生物学机制进行了深入了解。相关研究结果发表在国际学术期刊Oncogene上。
研究人员通过深度分析发现FOXD2-AS1在胃癌中显著上调并且与肿瘤大小,癌症发展阶段和不良预后存在正相关关系。他们又对GEO数据库进行基因富集分析,结果表明与细胞周期和DNA复制相关的基因在FOXD2-AS1高表达的病人中存在显著富集。功能研究表明FOXD2-AS1功能缺失能够通过抑制胃癌细胞的细胞周期进程抑制细胞生长,而FOXD2-AS1的表达上调能够促进癌症进展。
进一步的研究表明甲基转移酶EZH2和去甲基化酶LSD1能够与FOXD2-AS1结合并可以对其进行功能的调节。从机制上来说,FOXD-AS1通过EZH2和LSD1介导EphB3下调促进胃癌发生。这些结果表明在胃癌发生过程中FOXD2-AS1可以通过与EZH2和LSD1发生直接相互作用抑制EphB3发挥肿瘤诱导因子的作用,因此该分子或可成为检测癌症发生的新标志物。
9.Cell:开发出基于CRISPR的方法研究lncRNA的功能
doi:10.1016/j.cell.2018.03.052
如今,在一项开创性的研究中,来自美国贝丝以色列女执事医学中心等研究机构的研究人员开发出一种新方法来鉴定和确定lncRNA在急性髓细胞白血病(AML)对化疗药物产生耐药性中所起的功能作用。这种新技术将来自公开可获得的药理学数据库的信息与前沿的CRISPR技术相结合,筛选影响治疗反应的编码基因和非编码基因。总而言之,这种全基因组筛查平台可用于鉴定和确定与许多健康情况相关的lncRNA的功能。相关研究结果发表在2018年4月19日的Cell期刊上,论文标题为“An Integrated Genome-wide CRISPRa approach to Functionalize lncRNAs in Drug Resistance”。论文通信作者为贝丝以色列女执事医学中心的Pier Paolo Pandolfi教授。

图片来自Cell, doi:10.1016/j.cell.2018.03.052。
论文第一作者、Pandolfi实验室博士后研究员Assaf Bester博士说,“我们已知道哪些细胞系对这种药物敏感,哪些细胞对它不敏感。通过研究哪些基因可能在敏感性的细胞系和耐药性的细胞系中偏好地表达或受到抑制,我们能够预测哪些基因会促进耐药性产生。我们也可通过查看AML患者反应率数据来寻找可能与较差的存活率相关的基因。”
Pandolfi说,“如果我告诉你某个基因参与介导化疗药物耐药性,那么你可开展文献检索,找出关于这个基因的一些已知的信息,并提出你自己的假设。不过就非编码基因而言,没有什么文献可进行搜索。它们都是新的基因,而且我们仅是不知道它们发挥何种功能---它们的功能并未被描述过。”
为此,Pandolfi和同事们将生物信息学研究工作转移到体内测试。他们进行基于CRISPR的高通量筛选,以便独立地评估哪些基因可能决定着阿糖胞苷耐药性。这种CRISPR技术允许这些研究人员一次分析成千上万个编码基因和lncRNA,并可激活感兴趣的基因。这些研究人员随后利用阿糖胞苷处理细胞来观察这些基因如何作出反应。基因富集的丧失表明它在药物敏感性中发挥作用; 增强的基因富集意味着它介导耐药性。
10.Nat Commun:基于RNA分子的新型疗法有望治疗肺癌
doi:10.1038/s41467-018-03265-1
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自瑞典的科学家们表示,通过降低特殊RNA分子的活性就能使得小鼠肺部肿瘤缩小40%至50%,这或许是研究中的冰山一角,此外研究人员还从14类不同癌症中鉴别出了633个新型的生物标志物。
文章中,研究人员阐明了长链非编码RNA分子如何影响机体肿瘤的发育,这些分子是此前被分类为垃圾DNA的基因组中的一部分所产生的,研究人员发现这些RNA分子能够调节细胞分裂的能力。目前支持这项研究结果的证据是非常广泛的,研究人员对16种不同类型的癌症进行研究,其中包括6419份实体瘤,同时以701份正常组织为对照进行研究,研究人员的目的在于鉴别在细胞分裂期间处于活性状态的长链非编码RNA分子。
利用一种内部开发的新技术及现代的RNA测序技术,研究人员鉴别出了570个长链非编码RNA分子,依赖于不同的癌症类型这些RNA分子会进行不同程度地表达,同时研究者还发现,利用633种新型独立生物标志物就能预测和治疗14种类型的癌症,相关研究结果对于全球各地的癌症研究人员都非常重要。
11.PNAS:供血不足?请找lncRNAs帮助血管生长!
doi:10.1073/pnas.1715182115
一项近日发表的新研究发现一个新发现的基因可以在感受到组织血流不足的情况下帮助长出新血管。这项研究发表在《PNAS》上,由圣迈克尔医院生物医学科学研究中心的Philip Marsden博士及其实验室研究者Jeffrey Man博士领导完成。
Marsden博士实验室主要研究内皮细胞——围在血管壁内的一层细胞。在这项研究中,他们研究了一组新的基因——长非编码RNAs(lncRNAs)。所有细胞中都有RNA,传统观点认为它的主要工作是携带DNA信息翻译成蛋白质。但是lncRNAs有其他的功能,包括决定单个细胞在器官中扮演的最终角色。研究lncRNA给予了研究人员新机会找出可以帮助病人诊断的新的生物标记物和测试。
Man博士说,这项研究是第一次发现哪些lncRNAs在内皮细胞中更丰富。他们计划将这些信息公开,供给其他研究人员使用。
随后他们发现其中一个lncRNAs——STEEL负责感受微血管中的血流供应。Man说道,“很有趣的是STEEL帮助我们的身体对血供不足产生反应,会帮助长出更多的新血管。这些结果表明我们的身体就像我们需要的一样具有很优异的调节功能,同时也表明扰乱这种平衡会造成疾病。这些数据将进一步帮助我们加深对血管疾病的认识,并帮助我们找到改善伤后修复的方法。”
12.Nat Med:新研究发现无用的自私基因可以预防心脏病!
doi:10.1038/nm.4479
科学家们已经发现了一个基因,可能在预防心脏病中发挥重要保护作用。他们的研究发现基因MeXis在动脉栓塞组织中的关键细胞内帮助清除来自血管的过量胆固醇。这项研究发表在《Nature Medicine》上,由UCLA领导的研究团队在小鼠实验中发现MeXis控制着一个关键蛋白的表达,该蛋白可以将动脉血管壁上细胞内的胆固醇泵出细胞。

图片来源:Sallam Lab。
MeXis是自私基因的一个范例,自私基因是指一类不会产生蛋白因此被认为没有功能的基因。然而近年来的研究发现尽管这类无用的基因不会产生蛋白质,但是它们可以通过产生长非编码RNAs(lncRNAs)发挥重要的生物学功能。
“这项研究告诉我们lncRNAs对于涉及心脏病发展的细胞的内部功能很重要。”该研究通讯作者、UCLA大卫格芬医学院病理学和实验医学Frances and Albert Piansky教授Peter Tontonoz博士说道。“考虑到许多和MeXis一样的基因具有完全未知的功能,我们的研究表明进一步探索其他lncRNAs如何发挥功能将为正常生理学及疾病带来新的认识。”
在这项研究中,研究人员发现缺失MeXis的小鼠血管堵塞的概率是正常小鼠的两倍。此外,增加MeXis表达可以使细胞更有效地清除过量胆固醇。
13.Diabetes:北大学者发现影响肝脏糖脂代谢的新lncRNA
doi:10.2337/db17-0799
RNA不仅承担遗传信息中间载体的角色,还承担着各种调控功能,长非编码RNA(LncRNA)在发育和基因表达中发挥着复杂精确的调控功能。哺乳动物的基因组能够编码许多LncRNA但大部分LncRNA的功能仍然未知。最近一项研究发现了一个新的LncRNA在调节肝脏糖/脂质代谢方面的作用和机制,这个LncRNA叫做LncSHGL(LncRNA Suppressor of Hepatic Gluconeogenesis and Lipogenesis)。相关研究结果发表在国际学术期刊Diabetes上。
在这项研究中,研究人员发现在肥胖小鼠和非酒精性脂肪肝病人的肝脏中小鼠LncSHGL及其人类同源分子LncRNA B4GALT1-AS1的表达水平都存在下降。重新恢复肥胖糖尿病小鼠肝脏中LncSHGL的水平能够使高血糖症、胰岛素抵抗和肝脏脂肪变性得到改善,抑制肝脏LncSHGL能够促使正常小鼠出现高血糖症和肝脏脂肪沉积。在肥胖小鼠肝脏中过表达LncSHGL还可以增加Akt磷酸化水平,抑制糖异生和脂肪合成基因的表达,而在正常小鼠肝脏中抑制LncSHGL表达则表现出相反的表型。
从机制上来说,研究人员发现LncSHGL招募hnRNPA1来增强CALM mRNA的翻译效率增加CaM蛋白水平,不影响其转录,这会导致PI3K/Akt信号途径的激活抑制mTOR/SREBP-1c途径,并且不依赖肝脏细胞中的胰岛素和钙信号。肝脏中过表达hnRNPA1也会激活CaM/Akt信号途径,抑制mTOR/SREBP-1c途径改善肥胖小鼠的高血糖症和肝脏脂肪变性。
14.Nat Commun:神技能!仅通过操控单一RNA分子就足以逆转机体细胞衰老!
doi:10.1038/s41467-017-01921-6
近日,一篇发表在国际杂志Nature Communications上的研究报告中,来自葡萄牙里斯本大学的研究人员通过研究发现,通过操控单一的RNA分子就足以逆转细胞衰老。

图片来源:blog.njoyvision.com。
核糖核酸分子(RNA分子)主要负责细胞中蛋白质的产生,然而一类名为非编码RNA的特殊RNA分子却并不会翻译成为蛋白质分子,实际上,从2001年科学家们开始对人类基因组进行图谱绘制时,他们就知道人类基因组中实际上仅有大约2%的RNA会被翻译成为蛋白质。
如今在这项最新研究中,研究人员Bruno de Jesus及其同事利用遗传修饰的小鼠模型来研究细胞老化和再生的过程,他们发现,相比年轻小鼠的细胞而言,衍生自老年小鼠机体皮肤的细胞能够产生大量名为Zeb2-NAT的长链非编码RNA分子,通过降低机体中这类特殊RNA分子的水平,研究人员或许就有望有效再生老化的细胞。
15.Cell:新突破!抑制THOR表达有望阻止癌症产生
doi:10.1016/j.cell.2017.11.040
在一项新的研究中,来自美国密歇根大学综合癌症中心的研究人员在研究人基因组中之前未被探究的区域---人基因组中的暗物质,或者说非编码的DNA序列---时,发现了一个他们称之为THOR的新基因。相关研究结果发表在2017年12月14日的Cell期刊上,论文标题为“Oncogenic Role of THOR, a Conserved Cancer/Testis Long Non-coding RNA”。
这些研究人员描述了一种在人类、小鼠和斑马鱼中表达的长链非编码RNA(lncRNA)。不同寻常的是,这种类型的RNA在整个物种中是保守的。他们的想法是如果lncRNA在除人类之外的动物物种中发挥作用,那么它必须是比较重要的。
论文通信作者、密歇根大学病理学教授、密歇根大学密歇根转化病理学中心主任Arul Chinnaiyan博士说,“进化上保守的基因对生物学过程可能是比较重要的。我们发现THOR是一个高度保守的lncRNA的事实是激动人心的。鉴于我们认为它经过进化选择而具有重要的功能,我们选择着重关注它。”
事实上,这些研究人员发现这种特定的lncRNA在癌症产生中发挥着作用。通过基因手段将它敲除能够阻止肿瘤生长。这是首次鉴定出和描述THOR。THOR的全称是睾丸相关的高度保守的致癌性lncRNA(Testis-associated Highly-conserved Oncogenic long non-coding RNA)。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


