2019年4月Science期刊不得不看的亮点研究
来源:本站原创 2019-04-30 23:58
2019年4月30日讯/生物谷BIOON/---2019年4月份即将结束了,4月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Science:开发出一种检测CRISPR脱靶效应的新方法---DISCOVER-Seqdoi:10.1126/science.aav9023; doi:10.1126/science.aax1827自从CRISPR基因组编辑技术于20
2019年4月30日讯/生物谷BIOON/---2019年4月份即将结束了,4月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:开发出一种检测CRISPR脱靶效应的新方法---DISCOVER-Seq
doi:10.1126/science.aav9023; doi:10.1126/science.aax1827
自从CRISPR基因组编辑技术于2012年发明以来,它已经显示出治疗许多难治性疾病的巨大希望。然而,科学家们一直在努力在治疗相关的细胞类型中鉴定潜在的脱靶效应,这仍然是将治疗方法转移到临床应用的主要障碍。如今,在一项新的研究中,来自美国加州大学伯克利分校、加州大学旧金山分校、格拉德斯通研究所和瑞典阿斯利康公司的研究人员开发出一种可靠的方法来实现这一目标。相关研究结果发表在2019年4月19日的Science期刊上,论文标题为“Unbiased detection of CRISPR off-targets in vivo using DISCOVER-Seq”。论文通讯作者为加州大学伯克利分校的Jacob E. Corn。论文第一作者为加州大学伯克利分校的Beeke Wienert和Stacia Wyman。

CRISPR通过在特定位置切割DNA来编辑人的基因组。所面临的挑战是确保这种工具不会在其他地方进行切割,即一种被称为“脱靶效应”的DNA损伤,这可能会带来无法预料的后果。Wienert博士说,“当CRISPR进行切割时,DNA会被破坏。因此,为了生存,细胞将许多不同的DNA修复因子募集到基因组中的特定位点上以修复断裂并将切割末端连接在一起。我们认为如果我们能够找到这些DNA修复因子的位置,我们就可以鉴定出被CRISPR切割的位点。”
为了测试这种想法,这些研究人员研究了一组不同的DNA修复因子。他们发现其中的一种称为MRE11的DNA修复因子是DNA切割位点的第一批响应者之一。他们利用MRE11开发了一种名为DISCOVER-Seq的新技术,它可以识别出CRISPR切割基因组的确切位点。
Corn说,“鉴于我们的方法依赖于细胞的自然修复过程来识别切割位点,它经证实是一种侵入性更小、更可靠的方法。我们能够在诱导性多能干细胞、患者细胞和小鼠中测试我们新开发的DISCOVER-Seq方法,而且我们的研究结果表明这种方法可潜在地用于任何系统,而不仅仅是在实验室中。”
2.Science:揭示肿瘤抑制基因BAP1失活为何仅促进肿瘤在特定组织中形成
doi:10.1126/science.aav4902
众所周知,肿瘤抑制基因的丧失导致一小部分癌症出现在特定组织中。但是为什么仅是那些组织?由肿瘤抑制基因发生突变引起的恶性肿瘤具有不明原因的组织倾向性。比如,一种称为BAP1的肿瘤抑制基因编码组蛋白H2A的去泛素化酶,但是生殖细胞中的BAP1突变主要与葡萄膜黑色素瘤和间皮瘤存在关联。
在一项新的研究中,来自美国基因泰克公司的研究人员在一种BAP1诱导性癌症小鼠模型中,针对这种组织选择性如何作用于肿瘤抑制基因BAP1提供了一种相对简单的解释。相关研究结果发表在2019年4月19日的Science期刊上,论文标题为“Intrinsic apoptosis shapes the tumor spectrum linked to inactivation of the deubiquitinase BAP1”。
这些研究人员发现在包括小鼠胚胎干细胞、成纤维细胞、肝细胞和胰腺细胞在内的大多数细胞中,BAP1缺失会导致细胞凋亡,但是这不会诱导黑素细胞和间皮细胞凋亡。但是在形成肿瘤的组织中,即便BAP1不存在,具有抗凋亡作用的基因遭受的调节差异也会允许这些组织中的细胞存活下来。至少对这种肿瘤抑制基因而言,它的失活通常会导致细胞凋亡。然而,这种机制在一部分组织中失效了,从而允许这些组织中的细胞发生增殖并导致肿瘤产生。
泛素连接酶RNF2通过让组蛋白H2A发生单泛素化而使得基因受到沉默。在缺乏BAP1的细胞中,它通过抑制促存活基因Bcl2和Mcl1的表达来促进细胞凋亡。相比之下,黑素细胞中的BAP1缺失对促存活基因的表达几乎没有影响,但会诱导基因Mitf表达。
3.Science:揭示为何氯胺酮是一种抗抑郁药
doi:10.1126/science.aat8078; doi:10.1126/science.aax0719
在一项新的研究中,来自日本东京大学、美国斯坦福大学和威尔康乃尔医学院的研究人员在小鼠中鉴定出氯胺酮(ketamine)诱导的大脑相关变化有助于维持与抑郁症有关的行为的缓解,这一发现可能有助于人们开发出促进人类抑郁症持续缓解的干预措施。相关研究结果发表在2019年4月12日的Science期刊上,论文标题为“Sustained rescue of prefrontal circuit dysfunction by antidepressant-induced spine formation”。
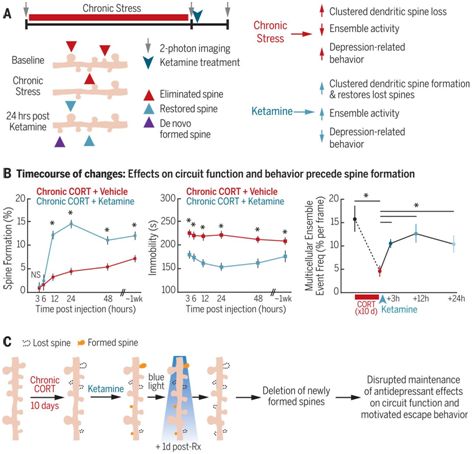
为了理解人体中从抑郁症发作到缓解转变背后的机制,这些研究人员在小鼠中研究了与抑郁相关的行为。在小鼠经历应激源之前和之后,他们获得了它们的前额叶皮质中的树突棘(dendritic spine)的高分辨率图像。树突棘是神经元中接收来自其他神经元的通信输入的突起。他们发现相比于没有暴露于应激源中的小鼠,显示出与抑郁有关的行为的小鼠在其前额皮质中的树突棘消除增加了和树突棘形成减少了。这一发现复制了之前开展的将与小鼠中抑郁相关的行为的出现与树突棘损失相关联在一起的研究。
除了对树突棘的影响外,应激还降低了小鼠前额叶皮质中神经元的功能性连接和同时活动。这种连接性和活动性的降低与应对应激源的抑郁症相关行为有关。Liston及其团队随后发现氯胺酮治疗快速恢复了神经元的功能连接和整体活动,并且消除了与抑郁有关的行为。相比于遭受应激但未接受氯胺酮治疗的小鼠,在接受单剂量氯胺酮治疗24小时后,遭受应激的小鼠表现出与抑郁相关的行为逆转和树突棘形成的增加。这些新的树突棘是功能性的,因而与其他神经元建立了工作上的关联性。
这些研究人员发现尽管小鼠的行为改变和神经活动变化发生很快(在接受氯胺酮治疗3小时后),但是树突棘的形成发生得更慢(在氯胺酮治疗12~24小时后)。虽然还需开展进一步的研究,但是他们认为这些发现可能表明树突棘再生是氯胺酮诱导的前额皮质回路活动恢复的结果。
4.Science:新研究发现太空飞行影响人体肠道细菌
doi:10.1126/science.aau8650; doi:10.1126/science.aaw7086
在美国航天局(NASA)标志性的双胞胎研究(Twins Study)中,美国研究人员发现长时间的太空飞行会影响人体肠道微生物组(gut microbiome)。相关研究结果发表在2019年4月12日的Science期刊上,论文标题为“The NASA Twins Study: A multidimensional analysis of a year-long human spaceflight”。
在国际空间站(ISS)长达一年的时间里,宇航员Scott Kelly在他的肠道微生物组中经历了两种主要细菌类型的比例变化。然而,他的肠道微生物组中的细菌多样性在太空飞行期间没有改变,这一发现令这些研究人员倍感鼓舞。
在西北大学开展的这项肠道微生物组研究是发表在2019年4月12日的Science期刊上的一篇综合性论文中的十项研究之一。在这10项研究中,每项研究都探讨了太空飞行如何影响人体的一个方面,包括基因表达、骨密度、免疫系统反应和端粒动力学的变化。
从2015年到2016年,Scott Kelly成为第一位在太空中度过近一整年的美国宇航员。Scott Kelly和他的同卵双胞胎兄弟---一名退役的宇航员--- Mark Kelly参加了由美国宇航局人类研究计划开展的一项前所未有的长达一年的研究。Mark Kelly为地球上的观察结果提供了基线,Scott Kelly在太空中提供了一个类似的测试案例。
这些研究人员研究了Scott Kelly肠道中的细菌组成随着时间和空间的变化而发生的变化。这对双胞胎在Scott Kelly前往太空前、在太空的一年期间和在返回地球后分别收集了后者的两份、四份和三分粪便样本。
90%以上的肠道细菌属于两大类:厚壁菌(Firmicutes)和拟杆菌(Bacteroidetes)。这两种细菌类型都含有有益菌和有害菌。Scott Kelly的肠道微生物组中的厚壁菌和拟杆菌之间的比例在太空飞行期间经历了明显的变化---厚壁菌的数量增加了,而拟杆菌的数量减少了。这种变化是这些研究人员在Scott Kelly的肠道微生物组中观察到的更大的组成变化之一,他的肠道微生物组在返回到地球后恢复正常。
5.Science:中美科学家解析出人甲状旁腺激素受体-1的三维结构
doi:10.1126/science.aav7942
在一项新的研究中,来自中国科学院、浙江大学医学院、复旦大学和美国匹兹堡大学、文安德尔研究所、麻省总医院和哈佛医学院的研究人员构建出一种分子复合物的三维图片,这可能有助于开发出更好地治疗骨质疏松症和癌症但具有更少副作用的药物。这些近原子分辨率图片描述了人甲状旁腺激素受体-1(parathyroid hormone receptor-1, PTH1R)的结构。相关研究结果发表在2019年4月12日的Science期刊上,论文标题为“Structure and dynamics of the active human parathyroid hormone receptor-1”。论文通讯作者为浙江大学医学院的张岩(Yan Zhang)、中国科学院上海药物研究所的王明伟(Ming-Wei Wang)、徐华强(H. Eric Xu)和匹兹堡大学的Jean-Pierre Vilardaga。
PTH1R是一种给细胞传递信号的分子,可与两种关键信使相互作用,其中的一种信使是一种模拟甲状旁腺素(PTH)的分子,可调节体内的钙水平,另一种信使是一种刺激性的G蛋白,可调节骨转换。这种分子复合物是由人PTH1R、PTH模拟物和刺激性的G蛋白组成的。
6.我国科学家在两篇Science论文中揭示植物免疫受体ZAR1激活机制
doi:10.1126/science.aav5868; doi:10.1126/science.aav5870; doi:10.1126/science.aax0174
尽管在十多亿年的进化中被区分开来,但是植物和动物都采用了类似的免疫策略来保护自己免受病原体侵害。一种重要的机制是由称为NLR的细胞质受体确定的,在植物中,NLR识别所谓的效应物,即入侵的微生物分泌到植物细胞中的分子。这些识别事件要么涉及NLR对效应物的直接识别,要么涉及NLR对效应物的间接识别,即NLR作为“保卫者(guard)”监测由效应物修饰的其他宿主蛋白或者说“被保护者(guardee)”。不论宿主直接识别还是间接识别效应物,都会导致细胞死亡,从而将微生物限制在感染部位。然而,到目前为止,我们还缺乏对植物NLR作用机制的详细了解,而且对这些分子如何在植物中发挥作用的理解在很大程度上是基于与动物NLR分子的比较。
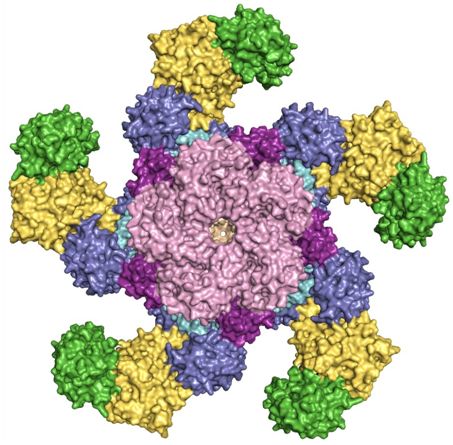
如今,在两项新的研究中,中国清华大学的王宏伟(Hong-Wei Wang)课题组、清华大学生命科学学院的柴继杰(Jijie Chai)课题组和中国科学院遗传与发育生物学研究所的周俭民(Jian-Min Zhou)课题组将无活性的NLR分子转化为提供抗病性的活性复合物的一连串分子事件拼凑在一起。相关研究结果都发表在2019年4月5日的Science期刊上,论文标题分别为“Ligand-triggered allosteric ADP release primes a plant NLR complex”和“Reconstitution and structure of a plant NLR resistosome conferring immunity”。
这些作者着重关注一种名为ZAR1的NLR受体。作为一种古老的植物分子,这种蛋白很可能具有广泛的重要性,这是因为它与多个'被保护者'相互作用,以便识别不相关的细菌效应物。
通过使用低温电镜,这些作者观察到,在细菌效应物不存在的情况下,ZAR1与植物蛋白RKS1一起通过涉及ZAR1蛋白的多个结构域的相互作用维持在静止状态。一旦遭受感染,细菌效应物修饰植物蛋白PBL2,这随后激活RKS1,从而导致巨大的构象变化,这些构象变化首先允许植物将ADP交换为ATP,接着导致一种五聚体的轮状结构组装,他们将这种结构称为“ZAR1抗病小体(ZAR1 resistosome)”。
这种结构的一个显著特征是它与动物NLR蛋白的相似性:动物NLR蛋白一旦被激活,也会组装成轮状结构,作为细胞死亡执行和免疫信号转导的信号平台。然而,植物NLR和动物NLR组装的轮状结构之间的一个重要差异为ZAR1如何诱导细胞死亡提供了诱人的线索。这些作者能够在ZAR1中鉴定出一种高度有序的漏斗样结构。这种漏斗样结构将ZAR1抗病小体拴在质膜上,而且也是细胞死亡和抗病性所必需的。他们推测ZAR1可能在质膜中形成孔,并以这种方式扰乱细胞功能,从而导致免疫信号转导和细胞死亡。
7.Science:发现一种阻止同类相食的小肽---SELF-1
doi:10.1126/science.aav9856
线虫最喜欢吃的食物是它的幼虫,它必须非常小心,不要意外地吃掉自己的后代。在一项新的研究中,来自德国马克斯-普朗克发育生物学研究所的研究人员发现这些仅一毫米长的微小线虫如何能够将自己的后代与其他线虫的后代区分开来,从而避免同类相食(cannibalism)。他们发现Pristionchus属线虫通过一种复杂的机制来识别它的后代。这些线虫在它们的表面上携带着一种较小的高度可变的似乎可由线虫鼻子检测到的蛋白。这种蛋白的可变部分可能起到自我识别代码的作用,即便发生一个氨基酸的变化也会导致同类相食。相关研究结果发表在2019年4月5日的Science期刊上,论文标题为“Small peptide–mediated self-recognition prevents cannibalism in predatory nematodes”。
论文通讯作者、马克斯-普朗克发育生物学研究所首席科学家Ralf Sommer说道,“自我识别在动植物王国中随处可见。它处于众多生物过程---从单细胞生物的聚集到各种动物的社会性或攻击性行为---的核心,而且也是负责抵御病原体的人类免疫系统的关键部分。然而,尽管自我识别普遍存在,但是这类有机体自我识别在此之前并没有在线虫中描述过。”Sommer将Pristionchus属线虫建立为与著名的秀丽隐杆线虫(Caenorhabditis elegans)进行比较研究的模式生物。
9.Science:新的ALS基因表达图谱为疾病进展提供了前所未有的细节
doi:10.1126/science.aav9776
在一项新的研究中,来自美国纽约基因组中心、布罗德研究所、哥伦比亚大学、斯坦福大学、纽约大学、弗莱提荣研究所(Flatiron Institute)和瑞典皇家理工学院的研究人员利用新技术绘制出脊髓样本的基因表达图谱,这就为肌肉侧索硬化症(ALS,也称渐冻人症)患者的疾病发生和进展机制提供了新的见解。他们将空间转录组学(spatial transcriptomics)和一种新的计算方法结合在一起,获得脊髓中将近1.2万个基因在时间和空间上的基因表达测量值。结果就是产生一种新的多维基因表达图谱。这种基因表达图谱提供了史无前例的细节和规模,并且提供了一个以前无法获得的关于ALS疾病进展的观点。相关研究结果发表在2019年4月5日的Science期刊上,论文标题为“Spatiotemporal dynamics of molecular pathology in amyotrophic lateral sclerosis”。论文通讯作者为纽约基因组中心的Hemali Phatnani博士、纽约大学的Richard Bonneau教授和瑞典皇家理工学院的Joakim Lundeberg博士。

这些研究人员描述了这种时空基因表达图谱如何揭示利用传统测序方法无法观察到的ALS疾病的早期变化。他们还开发出新的计算方法来揭示疾病驱动的中枢神经系统中所有细胞类型的许多信号通路的活性变化,这可能为开发治疗方法和诊断方法提供新的靶标。
与以往的转录组分析研究相比,这项研究的独特之处在于这些研究人员使用的空间转录组学方法,它能够同时在组织切片的许多位置产生RNAseq图谱。因此,他们能够精确地记录组织中几乎每个基因的表达位置。基于此,他们就能够精确记录组织中几乎每个基因的表达位置。他们在ALS小鼠模型中检测了疾病发展的四个时间点,从成年最早期到末期。此外,他们还对ALS患者死后的脊髓样本进行了检测。
在这项新的研究中,这些研究人员收集来自1165个小鼠组织切片的76136个空间基因表达测量值(spatial gene expression measurement, SGEM)和来自80个人类组织切片的61031个SGEM(对于背景而言,下一个最大可比空间分辨率转录组学研究在同一时间点仅考虑了大约12个组织切片)。通过将来自很多组织切片的数据结合在一起,他们能够在待检测的组织区域同时检测将近1.2万个基因的表达。这是首次使用这种空间分辨率方法在这种深度和规模上研究ALS。
10.Science重磅!钾离子是控制T细胞抗癌能力的关键所在!
doi:10.1126/science.aau0135
美国癌症研究所(NCI)癌症研究中心(CCR)的科学家领导的一项研究揭示了促进肿瘤在肿瘤杀伤性免疫细胞存在的条件下持续生长的一种方式,这项发现于近日发表在《Science》上,揭示了一种可以增强抗肿瘤免疫治疗疗法的新方法。
死亡的癌细胞会释放出钾离子,而在一些肿瘤中,钾的含量会达到很高的水平。该研究小组报告说,钾的升高会导致T细胞保持干细胞样的质量,或“干细胞性”,这与它们在免疫治疗过程中消除癌症的能力密切相关。研究结果表明,增加T细胞对钾的接触——或者模仿高钾的效果——可以使癌症免疫治疗更有效。
Restifo博士和他的团队此前曾证实,濒死癌细胞释放到肿瘤内的高水平的钾,可以阻止侵入肿瘤的杀死癌细胞的T细胞。在这项新的研究中,研究人员发现,在高钾条件下生长的T细胞也能保持T细胞的“干性”。这意味着,在肿瘤中,干细胞样T细胞有自我复制的能力,但它们不能成熟为杀伤免疫细胞。通过保持T细胞处于这种状态,肿瘤可以避免攻击并继续生长。这可以解释,为什么肿瘤中存在T细胞,但肿瘤细胞还可以继续生长。
然而,当干细胞样T细胞从肿瘤中取出,在实验室中大量生长,然后回到患者体内,干细胞样T细胞可以成熟为能够攻击肿瘤的杀伤细胞。Restifo博士解释说,T细胞保存下来的干性——也就是它们能够无限期地自我更新,并对刺激做出反应,成为抗癌细胞——可能是使过继细胞转移疗法成功的原因。
研究人员接下来探索了用高钾水平来保存T细胞的干细胞以用于治疗的疗效。他们发现,生长在高钾环境下的T细胞可以更有效地抑制移植到小鼠体内的原发性黑色素瘤和转移性黑色素瘤。他们还发现,当暴露于高浓度的钾时,从病人肿瘤中分离出来的T细胞和基因工程抗癌T细胞都具有更高水平的与持续生长和改善免疫治疗结果相关的标志物。
最后,研究团队证明,当他们使用特定的药物来模拟钾对小鼠T细胞的影响时,可以提高T细胞继续生长和消除肿瘤的能力。这意味着这种药物可能被用于诱导T细胞的干性,作为增强癌症免疫治疗的一种策略。(生物谷 Bioon.com)
1.Science:开发出一种检测CRISPR脱靶效应的新方法---DISCOVER-Seq
doi:10.1126/science.aav9023; doi:10.1126/science.aax1827
自从CRISPR基因组编辑技术于2012年发明以来,它已经显示出治疗许多难治性疾病的巨大希望。然而,科学家们一直在努力在治疗相关的细胞类型中鉴定潜在的脱靶效应,这仍然是将治疗方法转移到临床应用的主要障碍。如今,在一项新的研究中,来自美国加州大学伯克利分校、加州大学旧金山分校、格拉德斯通研究所和瑞典阿斯利康公司的研究人员开发出一种可靠的方法来实现这一目标。相关研究结果发表在2019年4月19日的Science期刊上,论文标题为“Unbiased detection of CRISPR off-targets in vivo using DISCOVER-Seq”。论文通讯作者为加州大学伯克利分校的Jacob E. Corn。论文第一作者为加州大学伯克利分校的Beeke Wienert和Stacia Wyman。

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
CRISPR通过在特定位置切割DNA来编辑人的基因组。所面临的挑战是确保这种工具不会在其他地方进行切割,即一种被称为“脱靶效应”的DNA损伤,这可能会带来无法预料的后果。Wienert博士说,“当CRISPR进行切割时,DNA会被破坏。因此,为了生存,细胞将许多不同的DNA修复因子募集到基因组中的特定位点上以修复断裂并将切割末端连接在一起。我们认为如果我们能够找到这些DNA修复因子的位置,我们就可以鉴定出被CRISPR切割的位点。”
为了测试这种想法,这些研究人员研究了一组不同的DNA修复因子。他们发现其中的一种称为MRE11的DNA修复因子是DNA切割位点的第一批响应者之一。他们利用MRE11开发了一种名为DISCOVER-Seq的新技术,它可以识别出CRISPR切割基因组的确切位点。
Corn说,“鉴于我们的方法依赖于细胞的自然修复过程来识别切割位点,它经证实是一种侵入性更小、更可靠的方法。我们能够在诱导性多能干细胞、患者细胞和小鼠中测试我们新开发的DISCOVER-Seq方法,而且我们的研究结果表明这种方法可潜在地用于任何系统,而不仅仅是在实验室中。”
2.Science:揭示肿瘤抑制基因BAP1失活为何仅促进肿瘤在特定组织中形成
doi:10.1126/science.aav4902
众所周知,肿瘤抑制基因的丧失导致一小部分癌症出现在特定组织中。但是为什么仅是那些组织?由肿瘤抑制基因发生突变引起的恶性肿瘤具有不明原因的组织倾向性。比如,一种称为BAP1的肿瘤抑制基因编码组蛋白H2A的去泛素化酶,但是生殖细胞中的BAP1突变主要与葡萄膜黑色素瘤和间皮瘤存在关联。
在一项新的研究中,来自美国基因泰克公司的研究人员在一种BAP1诱导性癌症小鼠模型中,针对这种组织选择性如何作用于肿瘤抑制基因BAP1提供了一种相对简单的解释。相关研究结果发表在2019年4月19日的Science期刊上,论文标题为“Intrinsic apoptosis shapes the tumor spectrum linked to inactivation of the deubiquitinase BAP1”。
这些研究人员发现在包括小鼠胚胎干细胞、成纤维细胞、肝细胞和胰腺细胞在内的大多数细胞中,BAP1缺失会导致细胞凋亡,但是这不会诱导黑素细胞和间皮细胞凋亡。但是在形成肿瘤的组织中,即便BAP1不存在,具有抗凋亡作用的基因遭受的调节差异也会允许这些组织中的细胞存活下来。至少对这种肿瘤抑制基因而言,它的失活通常会导致细胞凋亡。然而,这种机制在一部分组织中失效了,从而允许这些组织中的细胞发生增殖并导致肿瘤产生。
泛素连接酶RNF2通过让组蛋白H2A发生单泛素化而使得基因受到沉默。在缺乏BAP1的细胞中,它通过抑制促存活基因Bcl2和Mcl1的表达来促进细胞凋亡。相比之下,黑素细胞中的BAP1缺失对促存活基因的表达几乎没有影响,但会诱导基因Mitf表达。
3.Science:揭示为何氯胺酮是一种抗抑郁药
doi:10.1126/science.aat8078; doi:10.1126/science.aax0719
在一项新的研究中,来自日本东京大学、美国斯坦福大学和威尔康乃尔医学院的研究人员在小鼠中鉴定出氯胺酮(ketamine)诱导的大脑相关变化有助于维持与抑郁症有关的行为的缓解,这一发现可能有助于人们开发出促进人类抑郁症持续缓解的干预措施。相关研究结果发表在2019年4月12日的Science期刊上,论文标题为“Sustained rescue of prefrontal circuit dysfunction by antidepressant-induced spine formation”。

图片来自Science, 2019, doi:10.1126/science.aat8078。
为了理解人体中从抑郁症发作到缓解转变背后的机制,这些研究人员在小鼠中研究了与抑郁相关的行为。在小鼠经历应激源之前和之后,他们获得了它们的前额叶皮质中的树突棘(dendritic spine)的高分辨率图像。树突棘是神经元中接收来自其他神经元的通信输入的突起。他们发现相比于没有暴露于应激源中的小鼠,显示出与抑郁有关的行为的小鼠在其前额皮质中的树突棘消除增加了和树突棘形成减少了。这一发现复制了之前开展的将与小鼠中抑郁相关的行为的出现与树突棘损失相关联在一起的研究。
除了对树突棘的影响外,应激还降低了小鼠前额叶皮质中神经元的功能性连接和同时活动。这种连接性和活动性的降低与应对应激源的抑郁症相关行为有关。Liston及其团队随后发现氯胺酮治疗快速恢复了神经元的功能连接和整体活动,并且消除了与抑郁有关的行为。相比于遭受应激但未接受氯胺酮治疗的小鼠,在接受单剂量氯胺酮治疗24小时后,遭受应激的小鼠表现出与抑郁相关的行为逆转和树突棘形成的增加。这些新的树突棘是功能性的,因而与其他神经元建立了工作上的关联性。
这些研究人员发现尽管小鼠的行为改变和神经活动变化发生很快(在接受氯胺酮治疗3小时后),但是树突棘的形成发生得更慢(在氯胺酮治疗12~24小时后)。虽然还需开展进一步的研究,但是他们认为这些发现可能表明树突棘再生是氯胺酮诱导的前额皮质回路活动恢复的结果。
4.Science:新研究发现太空飞行影响人体肠道细菌
doi:10.1126/science.aau8650; doi:10.1126/science.aaw7086
在美国航天局(NASA)标志性的双胞胎研究(Twins Study)中,美国研究人员发现长时间的太空飞行会影响人体肠道微生物组(gut microbiome)。相关研究结果发表在2019年4月12日的Science期刊上,论文标题为“The NASA Twins Study: A multidimensional analysis of a year-long human spaceflight”。
在国际空间站(ISS)长达一年的时间里,宇航员Scott Kelly在他的肠道微生物组中经历了两种主要细菌类型的比例变化。然而,他的肠道微生物组中的细菌多样性在太空飞行期间没有改变,这一发现令这些研究人员倍感鼓舞。
在西北大学开展的这项肠道微生物组研究是发表在2019年4月12日的Science期刊上的一篇综合性论文中的十项研究之一。在这10项研究中,每项研究都探讨了太空飞行如何影响人体的一个方面,包括基因表达、骨密度、免疫系统反应和端粒动力学的变化。
从2015年到2016年,Scott Kelly成为第一位在太空中度过近一整年的美国宇航员。Scott Kelly和他的同卵双胞胎兄弟---一名退役的宇航员--- Mark Kelly参加了由美国宇航局人类研究计划开展的一项前所未有的长达一年的研究。Mark Kelly为地球上的观察结果提供了基线,Scott Kelly在太空中提供了一个类似的测试案例。
这些研究人员研究了Scott Kelly肠道中的细菌组成随着时间和空间的变化而发生的变化。这对双胞胎在Scott Kelly前往太空前、在太空的一年期间和在返回地球后分别收集了后者的两份、四份和三分粪便样本。
90%以上的肠道细菌属于两大类:厚壁菌(Firmicutes)和拟杆菌(Bacteroidetes)。这两种细菌类型都含有有益菌和有害菌。Scott Kelly的肠道微生物组中的厚壁菌和拟杆菌之间的比例在太空飞行期间经历了明显的变化---厚壁菌的数量增加了,而拟杆菌的数量减少了。这种变化是这些研究人员在Scott Kelly的肠道微生物组中观察到的更大的组成变化之一,他的肠道微生物组在返回到地球后恢复正常。
5.Science:中美科学家解析出人甲状旁腺激素受体-1的三维结构
doi:10.1126/science.aav7942
在一项新的研究中,来自中国科学院、浙江大学医学院、复旦大学和美国匹兹堡大学、文安德尔研究所、麻省总医院和哈佛医学院的研究人员构建出一种分子复合物的三维图片,这可能有助于开发出更好地治疗骨质疏松症和癌症但具有更少副作用的药物。这些近原子分辨率图片描述了人甲状旁腺激素受体-1(parathyroid hormone receptor-1, PTH1R)的结构。相关研究结果发表在2019年4月12日的Science期刊上,论文标题为“Structure and dynamics of the active human parathyroid hormone receptor-1”。论文通讯作者为浙江大学医学院的张岩(Yan Zhang)、中国科学院上海药物研究所的王明伟(Ming-Wei Wang)、徐华强(H. Eric Xu)和匹兹堡大学的Jean-Pierre Vilardaga。
PTH1R是一种给细胞传递信号的分子,可与两种关键信使相互作用,其中的一种信使是一种模拟甲状旁腺素(PTH)的分子,可调节体内的钙水平,另一种信使是一种刺激性的G蛋白,可调节骨转换。这种分子复合物是由人PTH1R、PTH模拟物和刺激性的G蛋白组成的。
6.我国科学家在两篇Science论文中揭示植物免疫受体ZAR1激活机制
doi:10.1126/science.aav5868; doi:10.1126/science.aav5870; doi:10.1126/science.aax0174
尽管在十多亿年的进化中被区分开来,但是植物和动物都采用了类似的免疫策略来保护自己免受病原体侵害。一种重要的机制是由称为NLR的细胞质受体确定的,在植物中,NLR识别所谓的效应物,即入侵的微生物分泌到植物细胞中的分子。这些识别事件要么涉及NLR对效应物的直接识别,要么涉及NLR对效应物的间接识别,即NLR作为“保卫者(guard)”监测由效应物修饰的其他宿主蛋白或者说“被保护者(guardee)”。不论宿主直接识别还是间接识别效应物,都会导致细胞死亡,从而将微生物限制在感染部位。然而,到目前为止,我们还缺乏对植物NLR作用机制的详细了解,而且对这些分子如何在植物中发挥作用的理解在很大程度上是基于与动物NLR分子的比较。

图片来自Jijie Chai。
如今,在两项新的研究中,中国清华大学的王宏伟(Hong-Wei Wang)课题组、清华大学生命科学学院的柴继杰(Jijie Chai)课题组和中国科学院遗传与发育生物学研究所的周俭民(Jian-Min Zhou)课题组将无活性的NLR分子转化为提供抗病性的活性复合物的一连串分子事件拼凑在一起。相关研究结果都发表在2019年4月5日的Science期刊上,论文标题分别为“Ligand-triggered allosteric ADP release primes a plant NLR complex”和“Reconstitution and structure of a plant NLR resistosome conferring immunity”。
这些作者着重关注一种名为ZAR1的NLR受体。作为一种古老的植物分子,这种蛋白很可能具有广泛的重要性,这是因为它与多个'被保护者'相互作用,以便识别不相关的细菌效应物。
通过使用低温电镜,这些作者观察到,在细菌效应物不存在的情况下,ZAR1与植物蛋白RKS1一起通过涉及ZAR1蛋白的多个结构域的相互作用维持在静止状态。一旦遭受感染,细菌效应物修饰植物蛋白PBL2,这随后激活RKS1,从而导致巨大的构象变化,这些构象变化首先允许植物将ADP交换为ATP,接着导致一种五聚体的轮状结构组装,他们将这种结构称为“ZAR1抗病小体(ZAR1 resistosome)”。
这种结构的一个显著特征是它与动物NLR蛋白的相似性:动物NLR蛋白一旦被激活,也会组装成轮状结构,作为细胞死亡执行和免疫信号转导的信号平台。然而,植物NLR和动物NLR组装的轮状结构之间的一个重要差异为ZAR1如何诱导细胞死亡提供了诱人的线索。这些作者能够在ZAR1中鉴定出一种高度有序的漏斗样结构。这种漏斗样结构将ZAR1抗病小体拴在质膜上,而且也是细胞死亡和抗病性所必需的。他们推测ZAR1可能在质膜中形成孔,并以这种方式扰乱细胞功能,从而导致免疫信号转导和细胞死亡。
7.Science:发现一种阻止同类相食的小肽---SELF-1
doi:10.1126/science.aav9856
线虫最喜欢吃的食物是它的幼虫,它必须非常小心,不要意外地吃掉自己的后代。在一项新的研究中,来自德国马克斯-普朗克发育生物学研究所的研究人员发现这些仅一毫米长的微小线虫如何能够将自己的后代与其他线虫的后代区分开来,从而避免同类相食(cannibalism)。他们发现Pristionchus属线虫通过一种复杂的机制来识别它的后代。这些线虫在它们的表面上携带着一种较小的高度可变的似乎可由线虫鼻子检测到的蛋白。这种蛋白的可变部分可能起到自我识别代码的作用,即便发生一个氨基酸的变化也会导致同类相食。相关研究结果发表在2019年4月5日的Science期刊上,论文标题为“Small peptide–mediated self-recognition prevents cannibalism in predatory nematodes”。
论文通讯作者、马克斯-普朗克发育生物学研究所首席科学家Ralf Sommer说道,“自我识别在动植物王国中随处可见。它处于众多生物过程---从单细胞生物的聚集到各种动物的社会性或攻击性行为---的核心,而且也是负责抵御病原体的人类免疫系统的关键部分。然而,尽管自我识别普遍存在,但是这类有机体自我识别在此之前并没有在线虫中描述过。”Sommer将Pristionchus属线虫建立为与著名的秀丽隐杆线虫(Caenorhabditis elegans)进行比较研究的模式生物。
9.Science:新的ALS基因表达图谱为疾病进展提供了前所未有的细节
doi:10.1126/science.aav9776
在一项新的研究中,来自美国纽约基因组中心、布罗德研究所、哥伦比亚大学、斯坦福大学、纽约大学、弗莱提荣研究所(Flatiron Institute)和瑞典皇家理工学院的研究人员利用新技术绘制出脊髓样本的基因表达图谱,这就为肌肉侧索硬化症(ALS,也称渐冻人症)患者的疾病发生和进展机制提供了新的见解。他们将空间转录组学(spatial transcriptomics)和一种新的计算方法结合在一起,获得脊髓中将近1.2万个基因在时间和空间上的基因表达测量值。结果就是产生一种新的多维基因表达图谱。这种基因表达图谱提供了史无前例的细节和规模,并且提供了一个以前无法获得的关于ALS疾病进展的观点。相关研究结果发表在2019年4月5日的Science期刊上,论文标题为“Spatiotemporal dynamics of molecular pathology in amyotrophic lateral sclerosis”。论文通讯作者为纽约基因组中心的Hemali Phatnani博士、纽约大学的Richard Bonneau教授和瑞典皇家理工学院的Joakim Lundeberg博士。

图片来自S. Maniatis et al./Science 2019。
这些研究人员描述了这种时空基因表达图谱如何揭示利用传统测序方法无法观察到的ALS疾病的早期变化。他们还开发出新的计算方法来揭示疾病驱动的中枢神经系统中所有细胞类型的许多信号通路的活性变化,这可能为开发治疗方法和诊断方法提供新的靶标。
与以往的转录组分析研究相比,这项研究的独特之处在于这些研究人员使用的空间转录组学方法,它能够同时在组织切片的许多位置产生RNAseq图谱。因此,他们能够精确地记录组织中几乎每个基因的表达位置。基于此,他们就能够精确记录组织中几乎每个基因的表达位置。他们在ALS小鼠模型中检测了疾病发展的四个时间点,从成年最早期到末期。此外,他们还对ALS患者死后的脊髓样本进行了检测。
在这项新的研究中,这些研究人员收集来自1165个小鼠组织切片的76136个空间基因表达测量值(spatial gene expression measurement, SGEM)和来自80个人类组织切片的61031个SGEM(对于背景而言,下一个最大可比空间分辨率转录组学研究在同一时间点仅考虑了大约12个组织切片)。通过将来自很多组织切片的数据结合在一起,他们能够在待检测的组织区域同时检测将近1.2万个基因的表达。这是首次使用这种空间分辨率方法在这种深度和规模上研究ALS。
10.Science重磅!钾离子是控制T细胞抗癌能力的关键所在!
doi:10.1126/science.aau0135
美国癌症研究所(NCI)癌症研究中心(CCR)的科学家领导的一项研究揭示了促进肿瘤在肿瘤杀伤性免疫细胞存在的条件下持续生长的一种方式,这项发现于近日发表在《Science》上,揭示了一种可以增强抗肿瘤免疫治疗疗法的新方法。
死亡的癌细胞会释放出钾离子,而在一些肿瘤中,钾的含量会达到很高的水平。该研究小组报告说,钾的升高会导致T细胞保持干细胞样的质量,或“干细胞性”,这与它们在免疫治疗过程中消除癌症的能力密切相关。研究结果表明,增加T细胞对钾的接触——或者模仿高钾的效果——可以使癌症免疫治疗更有效。
Restifo博士和他的团队此前曾证实,濒死癌细胞释放到肿瘤内的高水平的钾,可以阻止侵入肿瘤的杀死癌细胞的T细胞。在这项新的研究中,研究人员发现,在高钾条件下生长的T细胞也能保持T细胞的“干性”。这意味着,在肿瘤中,干细胞样T细胞有自我复制的能力,但它们不能成熟为杀伤免疫细胞。通过保持T细胞处于这种状态,肿瘤可以避免攻击并继续生长。这可以解释,为什么肿瘤中存在T细胞,但肿瘤细胞还可以继续生长。
然而,当干细胞样T细胞从肿瘤中取出,在实验室中大量生长,然后回到患者体内,干细胞样T细胞可以成熟为能够攻击肿瘤的杀伤细胞。Restifo博士解释说,T细胞保存下来的干性——也就是它们能够无限期地自我更新,并对刺激做出反应,成为抗癌细胞——可能是使过继细胞转移疗法成功的原因。
研究人员接下来探索了用高钾水平来保存T细胞的干细胞以用于治疗的疗效。他们发现,生长在高钾环境下的T细胞可以更有效地抑制移植到小鼠体内的原发性黑色素瘤和转移性黑色素瘤。他们还发现,当暴露于高浓度的钾时,从病人肿瘤中分离出来的T细胞和基因工程抗癌T细胞都具有更高水平的与持续生长和改善免疫治疗结果相关的标志物。
最后,研究团队证明,当他们使用特定的药物来模拟钾对小鼠T细胞的影响时,可以提高T细胞继续生长和消除肿瘤的能力。这意味着这种药物可能被用于诱导T细胞的干性,作为增强癌症免疫治疗的一种策略。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


