间充质干细胞研究进展(第2期)
来源:本站原创 2019-04-27 23:09
2019年4月27日讯/生物谷BIOON/---间充质干细胞具有低免疫原性及向缺血或损伤组织归巢的特征,输入宿主体内后,可归巢于特定部位,在微环境影响下定向分化为内胚层、中胚层以及外胚层3个胚层来源组织的细胞,如骨、软骨、肌腱、脂肪、肝、肾、皮肤、肌肉、神经甚至胰腺等10余种成熟细胞,因而成为再生医学中器官修复的理想种子细胞。最初是在骨髓中发现含有间充质干细胞,但是需要开展高度侵入性的骨髓捐献实验
2019年4月27日讯/生物谷BIOON/---间充质干细胞具有低免疫原性及向缺血或损伤组织归巢的特征,输入宿主体内后,可归巢于特定部位,在微环境影响下定向分化为内胚层、中胚层以及外胚层3个胚层来源组织的细胞,如骨、软骨、肌腱、脂肪、肝、肾、皮肤、肌肉、神经甚至胰腺等10余种成熟细胞,因而成为再生医学中器官修复的理想种子细胞。
最初是在骨髓中发现含有间充质干细胞,但是需要开展高度侵入性的骨髓捐献实验,另外随着年龄的增加间充质干细胞数目和分化潜能下降。最近,脐带血因为获取方法造成的损伤更少也被作为间充质干细胞的一种替代性来源。还有一个大有希望的间充质干细胞来源就是脂肪组织。这篇综述从形态、分离间充质干细胞的成功率、克隆集落形成频率、扩增潜能、多向分化能力和免疫表型这些方面对这三种间充质干细胞来源进行比较,表明脐带血和脂肪组织均可作为用于分离间充质干细胞的骨髓组织替代来源。另外,还人们还不断发现间充质干细胞也存在于脐带血、牙周韧带、羊水、真皮、骨膜、骨骼肌、胎肺、胎肝、胎盘和胰腺中。
间充质干细胞具有广阔的临床应用前景,可用于治疗神经系统疾病、肝肾损伤、自身免疫疾病、心脏疾病、骨疾病、软骨疾病、缺血性血管疾病、糖尿病并发症和肿瘤等疾病。它们也可用于组织工程和面部整形中。另外,它们也可与造血干细胞共同移植治疗血液疾病。 基于此,小编针对间充质干细胞近年来取得的研究进展,进行一番盘点,以飨读者。
1.Nature:因存在混乱,应停止使用术语间充质干细胞
doi:10.1038/d41586-018-06756-9
根据2018年9月26日发表在Nature期刊上的一篇标题为“Clear up this stem-cell mess”的评论文章,2017年科学期刊使用“间充质干细胞(mesenchymal stem cell, MSC)”发表了3500多篇论文。这个术语最初描述来自骨髓的细胞,但是它的使用已扩展到包含来自不同组织的多种类型的具有不同多能性水平的细胞。这些作者们认为,问题在于MSC并不总是被明确界定,这导致了科学界的混乱,以及企业利用公众的误解推销可疑的基于细胞的治疗方法。
作为这篇评论文章的作者之一,美国国家牙科与颅面研究所干细胞生物学家Pamela Robey告诉《科学家》杂志,“MSC的名称不应当使用。这仅是一个完全虚假的名称。存在组织特异性的干细胞/祖细胞,它们是很好的东西,却被归类到MSC中,不过使用这个术语意味着它们是相同的. . .它们真的不是。”
Robey和另外两位作者(日本理化学研究所科学家Douglas Sipp和美国明尼苏达大学生物伦理学家Leigh Turner)呼吁科学家们停止使用这一术语,这是因为他们认为这会持续导致科学界的混乱,并允许公司推销未经证实的干细胞疗法来误导消费者。
正如Robey及其同事们在这篇评论文章中叙述的那样,美国凯斯西储大学生物学家Arnold Caplan于1991年使用了MSC术语来描述从骨髓基质中分离出的干细胞,这些干细胞能够产生骨骼和软骨。他们写道,从那时起,研究人员就已从许多其他组织中分离出间充质干细胞(MSC),并在体外将它们分化为肾细胞、肝细胞、心脏细胞和神经细胞。
到20世纪90年代末,科学家们一直在使用术语MSC来描述从骨骼、脂肪和其他组织的基质区室中分离出的任何类型的细胞,这些细胞能够粘附在塑料培养皿上并在体外分化成其他的细胞类型。但是科学家们难以让这些细胞在体内分化,这让人们对它们的治疗能力产生了质疑。
2.SCRT:间充质干细胞可用于修复器官损伤
doi:10.1186/s13287-018-1103-y
在成人中,间充质干细胞(MSC)主要存在于骨髓中,它们在受损器官的修复中起重要作用。最近,由弗莱堡大学高分子化学研究所的Prasad Shastri教授和Melika Sarem博士领导的研究小组提出了自主控制MSCs软骨形成的证据。这些发现发表在《Stem Cell Research & Therapy》杂志上。
他们发现减少参与冷凝过程的细胞数量会导致内在分化程序的激活。即使在没有软骨诱导生长因子的情况下,无论供体年龄和性别如何,这都促使MSCs分化成为软骨细胞。 Sarem和Shastri进一步确定了两种细胞膜蛋白Caveolin-1和N-Cadherin在缩合步骤中受到差异调节,并起到像软骨分化的阴阳这样的相互作用力的作用。 “我们需要较小的细胞来制造质量更好的组织这一事实非常令人兴奋,因为它开辟了干细胞治疗的新途径”Sarem总结道。
与弗里夫斯瓦尔德大学的Oliver Otto博士合作,弗莱堡的研究人员证明,MSCs的软骨形成潜力与更严格的表型的出现和细胞大小的增加相关。他们的研究结果提到了MSC分化中迄今未知的机械生物学范式。 “由于从成人骨髓中采集的MSCs是异质细胞群,并且它们分化成软骨或骨细胞的能力因供体而异,因此我们的发现对于基于MSC的软骨和骨组织工程策略具有重要意义。”
3.Sci Transl Med:重磅!利用牙龈中的间充质干细胞来加速伤口愈合!
doi:10.1126/scitranslmed.aai8524
我们常常会注意到口腔内的伤口愈合速度会比其它部位的伤口愈合速度要快,牙龈组织的修复速度大约是皮肤损伤修复速度的两倍,而且其还能减少疤痕的形成,其中一个原因或许就是牙龈间充质干细胞(gingival mesenchymal stem cells,GMSCs),其能够产生多种类型的细胞;近日,一项刊登于国际杂志Science Translational Medicine上的研究报告中,来自宾夕法尼亚大学的科学家就通过研究阐明了牙龈间充质干细胞加速组织修复的新型分子机制。
期研究中,研究人员发现,间充质干细胞能够通过在胞外囊泡中释放信号分子来发挥多种功能,因此,理解如何有效区分牙龈组织和皮肤组织中间充质干细胞非常重要,这项研究中,研究人员对来自牙龈和皮肤中的间充质干细胞的功能进行了对比,他们发现,GMSCs包含多种蛋白质,包括炎症抑制因子IL-1RA,其能够阻断促炎性细胞因子的释放,同时IL-1RA还能被用作治疗风湿性关节炎的新型疗法。
随后研究人员重点寻找了到底是什么能够控制IL-1RA和其它细胞因子的释放,研究者推测这或许是Fas蛋白诱发的,因为该蛋白与机体的免疫调节存在一定关联;相比皮肤中的间充质干细胞而言,牙龈中的间充质干细胞含有更多的Fas蛋白,而且缺失Fas的小鼠机体中IL-1RA的水平也较低,其所释放的物质水平也会下降。随后的分子探针研究结果表明,Fas能够形成Fap-1和Cav-1的蛋白复合体来诱发小型胞外囊泡的释放,为了鉴别出这与伤口愈合的关联,研究人员对伤口组织进行了检测,他们发现,IL-1RA在伤口周围的GMSCs中水平会增加,而缺失IL-1RA的小鼠的牙龈愈合速度也会明显减慢。
相比较而言,当研究人员从GMSCs分离IL-1RA后,并将其注射到创伤部位时,明显加速了伤口的愈合速度。研究者Kou说道,我们发现,间充质干细胞,尤其是牙龈中的间充质干细胞能够通过胞外囊泡释放大量的细胞因子;相关研究发现或许对于糖尿病患者具有明显的治疗意义,研究者指出,相比健康小鼠的GMSCs而言,糖尿病小鼠机体中GMSCs或许并不太会分泌胞外囊泡,而且其GMSCs中也存在较低水平的IL-1RA分泌,引入健康小鼠机体中GMSCs所释放的胞外囊泡就能够降低糖尿病小鼠的愈合时间。
4.Rejuv Res:干细胞疗法会成为神经退行性疾病的最佳希望吗?
doi:10.1089/rej.2017.1946
由于大脑的自身修复或再生能力有限,干细胞或将成为针对受伤、衰老或疾病造成的大脑组织损伤或退化的最好治疗方法。虽然干细胞疗法在前临床测试中表现出了希望,但在动物试验中的得到的结果在人类患者中并不一定有效,并且人类临床研究会受到规模和数量的限制。最近在Mary Ann Liebert,Inc.出版社出版的同行评议期刊Rejuvenation Research上发表的一项研究关注了干细胞和新兴治疗药物在神经退行性疾病中的潜在价值。
意大利巴勒莫大学的Martina Nasello, Giuseppe Schirò, Floriana Crapanzano和Carmela Rita Balistreri回顾了已发表的文献和一些近期的数据。近期的数据评估了干细胞和其它有潜力的治疗物质在神经退行性疾病的预防和治疗中的效果。他们把结果发布在标题为"Stem Cells and Other Emerging Agents as Innovative 'Drugs' in Neurodegenerative Diseases: Benefits and Limitations."的文章上。

研究者们讨论了使用不同类型干细胞作为治疗手段的潜在优势和障碍,包括胚胎干细胞(ESC)、间充质干细胞(MSC)诱导多能干细胞(ipsC)和神经干细胞(NSC)。他们也提供了证据来支持对二甲双胍和褪黑激素混合物和白藜芦醇、姜黄素和乙酰左旋肉碱等天然抗氧化剂的更深入研究。
5.PNAS:神奇!仅需改变干细胞中的水分就可决定着它的命运
doi:10.1073/pnas.1705179114
在一项新的研究中,来自美国哈佛大学和中国西安交通大学等研究机构的研究人员仅通过改变小鼠干细胞中的水含量,就改变了这些干细胞的命运。他们发现移除小鼠间充质干细胞(mesenchymal stem cells)中的水分,让它们变得更硬,从而让它们变成骨组织,然而往这些间充质干细胞中添加水分,让它们变得更柔软,从而让它们变成脂肪组织。相关研究结果近期发表PNAS期刊上,论文标题为“Cell volume change through water efflux impacts cell stiffness and stem cell fate”。
论文第一作者、美国麻省理工大学机械工程系助理教授郭明(Ming Guo)博士在一篇新闻稿中说道,“我们首次开始理解细胞容积和细胞水含量在细胞的机械性能和生理功能上的重要性。” 这些研究人员在他们的报道中写道,细胞的容积能够极大地影响它的特征,包括硬度、蛋白转运和染色质密度。在一组旨在观察细胞如何调控它们的容积的实验中,他们在具有不同硬度的基板上培养星形胶质细胞。在最为坚硬的基板上培养的那些星形胶质细胞通过释放水分变得最为坚硬。
已知硬度会影响干细胞的命运,因此这些研究人员利用间充质干细胞开展另一组实验来观察水分从细胞中流出在这种关系中发挥什么作用。在通常促进间充质干细胞分化为骨细胞的坚硬基板表面上,通过降低这些干细胞的渗透压,因而让它们吸收水分而变得膨胀,它们能够分化为脂肪细胞。类似地,在通常促进脂肪细胞产生的柔软基板表面上,让间充质干细胞遭受更大的渗透压时,它们更可能倾向于变成骨细胞。
6.Stem Cell Res & Ther:来自老年机体的人类诱导多能干细胞衍生的间充质干细胞或能“返老还童”
doi:10.1186/s13287-019-1209-x
原代间充质干细胞(MSCs)的使用往往充满着与年龄相关的不足,诸如有限的扩张及过早衰老等,人类诱导多能干细胞所衍生的间充质干细胞(iMSCs,induced pluripotent stem cells-derived MSCs)已经被证明是MSCs的游泳临床来源,其能有效克服与衰老相关的一些缺点,这一概念的重要性体现在了一项1期临床试验的治疗中。
近日,一项刊登在国际杂志Stem Cell Research & Therapy上的研究报告中,来自海涅大学等机构的科学家们就通过研究分析了iMSCs中与恢复活力相关的标志是如何获取的。研究者比较了分化自胚胎干细胞(ESCs-H1)的iMSCs和iPSCs(诱导多能干细胞)之间在细胞特性、转录组和分泌组上的差异,ipsCs源于年轻人和老年人机体中的MSCs,其所产生的iMSCs(与来源无关)符合MSCs的标准,而且系统树分析结果证实,所有iMSCs的转录组与亲本的MSCs能聚集在一起,但却不同于多能干细胞。
与供体的年龄和初始细胞类型无关,iMSCs能够获得与活力恢复相关的50个基因特性,这些基因会在多能干细胞中表达,但在亲本的MSCs中并不会表达。值得注意的是,在再生医学研究上,iMSCs能够获得与原代MSCs相类似的分泌蛋白质组,这就突出了其通过旁分泌信号通路进行传导的能力。
7.Stem Cells Dev:发现骨形成的新型调节因子
doi:10.1089/scd.2018.0152
研究人员发现了小鼠体内一种新的转录因子可以帮助调节间充质干细胞(mesenchymal stem cells,MSCs)分化为骨的过程。目前科学家们对于骨细胞分化的研究并不深入,而MSCs则是再生医学领域一种很有潜力的干细胞来源。
这个新的转录因子叫做成骨细胞诱导因子1(Osteoblast Inducer 1,ObI-1),相关研究成果于近日发表在《Stem Cells and Development》上。这篇文章叫做“Identification of a Novel Transcription Factor Required for Osteogenic Differentiation of Mesenchymal Stem Cells”,作者包括来自意大利那不勒斯大学费德里科二世的Francesca Querques和Anna DAgostino以及他们的同事,还有一组来自西班牙CRG基因调控中心的科学家。
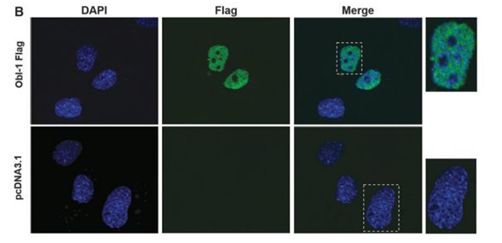
研究人员在对MSCs进行筛查的时候发现了Obl-1,随后他们进行了深入研究,发现这个因子在一定程度上通过刺激BMP信号通路控制Runx2的表达来发挥作用。
“Lucio Pastore及其同事第一次报道了一个他们称之为成骨细胞诱导因子1的新型转录因子,它可以通过控制Runx2上游信号来控制骨分化。在他们的文章中,他们在多功小鼠骨髓细胞和原代小鼠间充质干细胞上利用基因敲除和过表达实验验证了这些结果。”该杂志主编、韦恩州立大学医学院的Graham C. Parker博士这样说道。
8.FASEB J:静态磁场可以促进3D打印的钛支架介导的骨修复
doi:10.1096/fj.201802195R
自从2016年发现3D打印(3DP)的多孔钛支架以来,科学界一直在探索提高它们刺激骨生成或者骨重塑能力的方法。近日一项发表在《The FASEB Journal》上的文章发现使用静态磁场(Static Magnetic Field,SMF)刺激3DP支架可以在体内外激活人骨来源的间充质干细胞(human bone-derived mesenchymal stem cells,hBMSCs)的成骨潜力。
研究人员使用hBMSCs和动物模型进行了相关实验。他们将hBMSCs植入到3DP支架表面之后,将细胞分为了4组,第一组作为对照组。随后他们将剩下的三组分别暴露在磁场强度为50、100、150毫特斯拉(milliTesla,mT)的磁场中,并在接下来14天持续观察这些细胞。研究人员发现SMF刺激的细胞成骨潜力显著高于对照组。此外,研究人员还发现磁场强度越大,成骨能力越强。
为了进行动物实验,研究人员创造了一个骨缺陷的大鼠模型。将大鼠分为两组后,研究人员将第一组作为对照组,将第二组暴露在100 mT的SMF中。12周后,研究人员发现SMF处理的大鼠生成了更多的新骨组织。
9.PNAS:弹性蛋白原或能促进干细胞生长 有望加速新型干细胞疗法的开发
doi:10.1073/pnas.1812951116
近日,一项刊登在国际杂志Proceedings of the National Academy of Sciences上的研究报告中,来自悉尼大学的科学家们通过研究发现,一种用于制造弹性外科凝胶剂(胶水)的原料—弹性蛋白原(tropoelastin)或能促进干细胞生长并帮助机体进行自我修复。干细胞能帮助机体修复并组建包括皮肤和肌肉等多种人体组织,多年以来研究人员一直在寻找新方法让干细胞能够更好地发挥作用,但并未取得显著的成果。
这项研究中,研究人员开发了一种新方法,即利用弹性蛋白原就能快速廉价地产生更多干细胞,弹性蛋白原能赋予活体组织伸展和收缩的能力;研究者表示,这种新方法能够快速有效地促进间质干细胞生长和补充。Giselle Yeo博士解释道,如今越来越多的科学家开始利用干细胞开发新型细胞疗法治疗一系列利用常规疗法无法治疗的人类疾病,包括骨骼组织损伤、心脏病、退行性疾病和器官衰竭等。但很不幸的是,由于干细胞供应不足,基于干细胞的细胞疗法的广泛应用受到了明显的抑制。
本文中研究者所开发的方法能够明显降低当前许多细胞疗法的高额成本,研究者表示,利用来自供体机体的干细胞研究发现,当施加少量的弹性蛋白原时,其就能促进更多的细胞产生,相比在干细胞培养过程中添加蛋白质而言,弹性蛋白原能够制造一种促进干细胞生长增殖的绝佳环境。干细胞常常需要一个生存和增殖的环境,如果能创造一个干细胞生长所需的良好环境,那么研究者就有望获得大量干细胞,而弹性蛋白原就能够完成这一目标。
下一步研究人员还将继续深入研究检测弹性蛋白原在人类机体中的作用效率,研究者希望,利用这种方法制造出的干细胞能够帮助机体修复损伤,并促进其它细胞移动至损伤区域,更好地促进机体进行自我修复。
10.Cell Rep:中科院和北大合作发现治疗关节炎的新靶标
doi:10.1016/j.celrep.2019.02.088
衰老是骨关节炎(osteoarthritis, OA)的一个风险因素,这是一种以关节软骨降解导致疼痛和残疾为特点的慢性疾病。研究人员已经从OA患者关节组织中分离出衰老间充质干细胞(Senescent mesenchymal stem cells,hMSCs)。而hMSCs是一个针对组织退化的重要治疗靶标。
经过4年的研究之后,来自中国科学院动物研究所、北京大学生物物理研究所的科学家们在《Cell Reports》上报道了他们的研究成果,他们发现蛋白因子CBX4可以帮助治疗小鼠的OA。科学家们发现CBX4可以通过调节核仁结构和功能来保护hMSCs不衰老。重要的是CBX4过表达可以缓解小鼠OA的发展,这表明CBX4是一个可以靶向干预的治疗靶点。
CBX4是核心蛋白复合体PRC1(Polycomb repressive complex 1)的一个组成部分,通过基因沉默在调节细胞身份和器官发育中扮演关键角色。衰老的hMSCs中的CBX4被下调,而敲除hMSCs中的CBX4会导致核仁异染色质不稳定,增强核糖体生物的发生,增加蛋白质翻译,加速细胞衰老。
CBX4通过将核仁蛋白——纤溶蛋白和异染色质蛋白KRAB相关蛋白1(KRAB-associated protein 1,KAP1)招募到核仁rDNA上,限制过量rRNAs的表达。CBX4的过表达可以消除hMSCs生理衰老并减缓小鼠OA的发展。这些发现不仅强调了CBX4介导的核仁稳定性对于防止hMSCs衰老的重要性,还为防止衰老相关干细胞衰竭提供了新方法,有望用于治疗衰老相关疾病。(生物谷 Bioon.com)
最初是在骨髓中发现含有间充质干细胞,但是需要开展高度侵入性的骨髓捐献实验,另外随着年龄的增加间充质干细胞数目和分化潜能下降。最近,脐带血因为获取方法造成的损伤更少也被作为间充质干细胞的一种替代性来源。还有一个大有希望的间充质干细胞来源就是脂肪组织。这篇综述从形态、分离间充质干细胞的成功率、克隆集落形成频率、扩增潜能、多向分化能力和免疫表型这些方面对这三种间充质干细胞来源进行比较,表明脐带血和脂肪组织均可作为用于分离间充质干细胞的骨髓组织替代来源。另外,还人们还不断发现间充质干细胞也存在于脐带血、牙周韧带、羊水、真皮、骨膜、骨骼肌、胎肺、胎肝、胎盘和胰腺中。
间充质干细胞具有广阔的临床应用前景,可用于治疗神经系统疾病、肝肾损伤、自身免疫疾病、心脏疾病、骨疾病、软骨疾病、缺血性血管疾病、糖尿病并发症和肿瘤等疾病。它们也可用于组织工程和面部整形中。另外,它们也可与造血干细胞共同移植治疗血液疾病。 基于此,小编针对间充质干细胞近年来取得的研究进展,进行一番盘点,以飨读者。
1.Nature:因存在混乱,应停止使用术语间充质干细胞
doi:10.1038/d41586-018-06756-9
根据2018年9月26日发表在Nature期刊上的一篇标题为“Clear up this stem-cell mess”的评论文章,2017年科学期刊使用“间充质干细胞(mesenchymal stem cell, MSC)”发表了3500多篇论文。这个术语最初描述来自骨髓的细胞,但是它的使用已扩展到包含来自不同组织的多种类型的具有不同多能性水平的细胞。这些作者们认为,问题在于MSC并不总是被明确界定,这导致了科学界的混乱,以及企业利用公众的误解推销可疑的基于细胞的治疗方法。

图片来自Steve Gschmeissner/SPL。
Robey和另外两位作者(日本理化学研究所科学家Douglas Sipp和美国明尼苏达大学生物伦理学家Leigh Turner)呼吁科学家们停止使用这一术语,这是因为他们认为这会持续导致科学界的混乱,并允许公司推销未经证实的干细胞疗法来误导消费者。
正如Robey及其同事们在这篇评论文章中叙述的那样,美国凯斯西储大学生物学家Arnold Caplan于1991年使用了MSC术语来描述从骨髓基质中分离出的干细胞,这些干细胞能够产生骨骼和软骨。他们写道,从那时起,研究人员就已从许多其他组织中分离出间充质干细胞(MSC),并在体外将它们分化为肾细胞、肝细胞、心脏细胞和神经细胞。
到20世纪90年代末,科学家们一直在使用术语MSC来描述从骨骼、脂肪和其他组织的基质区室中分离出的任何类型的细胞,这些细胞能够粘附在塑料培养皿上并在体外分化成其他的细胞类型。但是科学家们难以让这些细胞在体内分化,这让人们对它们的治疗能力产生了质疑。
2.SCRT:间充质干细胞可用于修复器官损伤
doi:10.1186/s13287-018-1103-y
在成人中,间充质干细胞(MSC)主要存在于骨髓中,它们在受损器官的修复中起重要作用。最近,由弗莱堡大学高分子化学研究所的Prasad Shastri教授和Melika Sarem博士领导的研究小组提出了自主控制MSCs软骨形成的证据。这些发现发表在《Stem Cell Research & Therapy》杂志上。
他们发现减少参与冷凝过程的细胞数量会导致内在分化程序的激活。即使在没有软骨诱导生长因子的情况下,无论供体年龄和性别如何,这都促使MSCs分化成为软骨细胞。 Sarem和Shastri进一步确定了两种细胞膜蛋白Caveolin-1和N-Cadherin在缩合步骤中受到差异调节,并起到像软骨分化的阴阳这样的相互作用力的作用。 “我们需要较小的细胞来制造质量更好的组织这一事实非常令人兴奋,因为它开辟了干细胞治疗的新途径”Sarem总结道。
与弗里夫斯瓦尔德大学的Oliver Otto博士合作,弗莱堡的研究人员证明,MSCs的软骨形成潜力与更严格的表型的出现和细胞大小的增加相关。他们的研究结果提到了MSC分化中迄今未知的机械生物学范式。 “由于从成人骨髓中采集的MSCs是异质细胞群,并且它们分化成软骨或骨细胞的能力因供体而异,因此我们的发现对于基于MSC的软骨和骨组织工程策略具有重要意义。”
3.Sci Transl Med:重磅!利用牙龈中的间充质干细胞来加速伤口愈合!
doi:10.1126/scitranslmed.aai8524
我们常常会注意到口腔内的伤口愈合速度会比其它部位的伤口愈合速度要快,牙龈组织的修复速度大约是皮肤损伤修复速度的两倍,而且其还能减少疤痕的形成,其中一个原因或许就是牙龈间充质干细胞(gingival mesenchymal stem cells,GMSCs),其能够产生多种类型的细胞;近日,一项刊登于国际杂志Science Translational Medicine上的研究报告中,来自宾夕法尼亚大学的科学家就通过研究阐明了牙龈间充质干细胞加速组织修复的新型分子机制。
期研究中,研究人员发现,间充质干细胞能够通过在胞外囊泡中释放信号分子来发挥多种功能,因此,理解如何有效区分牙龈组织和皮肤组织中间充质干细胞非常重要,这项研究中,研究人员对来自牙龈和皮肤中的间充质干细胞的功能进行了对比,他们发现,GMSCs包含多种蛋白质,包括炎症抑制因子IL-1RA,其能够阻断促炎性细胞因子的释放,同时IL-1RA还能被用作治疗风湿性关节炎的新型疗法。
随后研究人员重点寻找了到底是什么能够控制IL-1RA和其它细胞因子的释放,研究者推测这或许是Fas蛋白诱发的,因为该蛋白与机体的免疫调节存在一定关联;相比皮肤中的间充质干细胞而言,牙龈中的间充质干细胞含有更多的Fas蛋白,而且缺失Fas的小鼠机体中IL-1RA的水平也较低,其所释放的物质水平也会下降。随后的分子探针研究结果表明,Fas能够形成Fap-1和Cav-1的蛋白复合体来诱发小型胞外囊泡的释放,为了鉴别出这与伤口愈合的关联,研究人员对伤口组织进行了检测,他们发现,IL-1RA在伤口周围的GMSCs中水平会增加,而缺失IL-1RA的小鼠的牙龈愈合速度也会明显减慢。
相比较而言,当研究人员从GMSCs分离IL-1RA后,并将其注射到创伤部位时,明显加速了伤口的愈合速度。研究者Kou说道,我们发现,间充质干细胞,尤其是牙龈中的间充质干细胞能够通过胞外囊泡释放大量的细胞因子;相关研究发现或许对于糖尿病患者具有明显的治疗意义,研究者指出,相比健康小鼠的GMSCs而言,糖尿病小鼠机体中GMSCs或许并不太会分泌胞外囊泡,而且其GMSCs中也存在较低水平的IL-1RA分泌,引入健康小鼠机体中GMSCs所释放的胞外囊泡就能够降低糖尿病小鼠的愈合时间。
4.Rejuv Res:干细胞疗法会成为神经退行性疾病的最佳希望吗?
doi:10.1089/rej.2017.1946
由于大脑的自身修复或再生能力有限,干细胞或将成为针对受伤、衰老或疾病造成的大脑组织损伤或退化的最好治疗方法。虽然干细胞疗法在前临床测试中表现出了希望,但在动物试验中的得到的结果在人类患者中并不一定有效,并且人类临床研究会受到规模和数量的限制。最近在Mary Ann Liebert,Inc.出版社出版的同行评议期刊Rejuvenation Research上发表的一项研究关注了干细胞和新兴治疗药物在神经退行性疾病中的潜在价值。
意大利巴勒莫大学的Martina Nasello, Giuseppe Schirò, Floriana Crapanzano和Carmela Rita Balistreri回顾了已发表的文献和一些近期的数据。近期的数据评估了干细胞和其它有潜力的治疗物质在神经退行性疾病的预防和治疗中的效果。他们把结果发布在标题为"Stem Cells and Other Emerging Agents as Innovative 'Drugs' in Neurodegenerative Diseases: Benefits and Limitations."的文章上。

5.PNAS:神奇!仅需改变干细胞中的水分就可决定着它的命运
doi:10.1073/pnas.1705179114
在一项新的研究中,来自美国哈佛大学和中国西安交通大学等研究机构的研究人员仅通过改变小鼠干细胞中的水含量,就改变了这些干细胞的命运。他们发现移除小鼠间充质干细胞(mesenchymal stem cells)中的水分,让它们变得更硬,从而让它们变成骨组织,然而往这些间充质干细胞中添加水分,让它们变得更柔软,从而让它们变成脂肪组织。相关研究结果近期发表PNAS期刊上,论文标题为“Cell volume change through water efflux impacts cell stiffness and stem cell fate”。
论文第一作者、美国麻省理工大学机械工程系助理教授郭明(Ming Guo)博士在一篇新闻稿中说道,“我们首次开始理解细胞容积和细胞水含量在细胞的机械性能和生理功能上的重要性。” 这些研究人员在他们的报道中写道,细胞的容积能够极大地影响它的特征,包括硬度、蛋白转运和染色质密度。在一组旨在观察细胞如何调控它们的容积的实验中,他们在具有不同硬度的基板上培养星形胶质细胞。在最为坚硬的基板上培养的那些星形胶质细胞通过释放水分变得最为坚硬。
已知硬度会影响干细胞的命运,因此这些研究人员利用间充质干细胞开展另一组实验来观察水分从细胞中流出在这种关系中发挥什么作用。在通常促进间充质干细胞分化为骨细胞的坚硬基板表面上,通过降低这些干细胞的渗透压,因而让它们吸收水分而变得膨胀,它们能够分化为脂肪细胞。类似地,在通常促进脂肪细胞产生的柔软基板表面上,让间充质干细胞遭受更大的渗透压时,它们更可能倾向于变成骨细胞。
6.Stem Cell Res & Ther:来自老年机体的人类诱导多能干细胞衍生的间充质干细胞或能“返老还童”
doi:10.1186/s13287-019-1209-x
原代间充质干细胞(MSCs)的使用往往充满着与年龄相关的不足,诸如有限的扩张及过早衰老等,人类诱导多能干细胞所衍生的间充质干细胞(iMSCs,induced pluripotent stem cells-derived MSCs)已经被证明是MSCs的游泳临床来源,其能有效克服与衰老相关的一些缺点,这一概念的重要性体现在了一项1期临床试验的治疗中。
近日,一项刊登在国际杂志Stem Cell Research & Therapy上的研究报告中,来自海涅大学等机构的科学家们就通过研究分析了iMSCs中与恢复活力相关的标志是如何获取的。研究者比较了分化自胚胎干细胞(ESCs-H1)的iMSCs和iPSCs(诱导多能干细胞)之间在细胞特性、转录组和分泌组上的差异,ipsCs源于年轻人和老年人机体中的MSCs,其所产生的iMSCs(与来源无关)符合MSCs的标准,而且系统树分析结果证实,所有iMSCs的转录组与亲本的MSCs能聚集在一起,但却不同于多能干细胞。
与供体的年龄和初始细胞类型无关,iMSCs能够获得与活力恢复相关的50个基因特性,这些基因会在多能干细胞中表达,但在亲本的MSCs中并不会表达。值得注意的是,在再生医学研究上,iMSCs能够获得与原代MSCs相类似的分泌蛋白质组,这就突出了其通过旁分泌信号通路进行传导的能力。
7.Stem Cells Dev:发现骨形成的新型调节因子
doi:10.1089/scd.2018.0152
研究人员发现了小鼠体内一种新的转录因子可以帮助调节间充质干细胞(mesenchymal stem cells,MSCs)分化为骨的过程。目前科学家们对于骨细胞分化的研究并不深入,而MSCs则是再生医学领域一种很有潜力的干细胞来源。
这个新的转录因子叫做成骨细胞诱导因子1(Osteoblast Inducer 1,ObI-1),相关研究成果于近日发表在《Stem Cells and Development》上。这篇文章叫做“Identification of a Novel Transcription Factor Required for Osteogenic Differentiation of Mesenchymal Stem Cells”,作者包括来自意大利那不勒斯大学费德里科二世的Francesca Querques和Anna DAgostino以及他们的同事,还有一组来自西班牙CRG基因调控中心的科学家。

图片来源:Stem Cells and Development。
研究人员在对MSCs进行筛查的时候发现了Obl-1,随后他们进行了深入研究,发现这个因子在一定程度上通过刺激BMP信号通路控制Runx2的表达来发挥作用。
“Lucio Pastore及其同事第一次报道了一个他们称之为成骨细胞诱导因子1的新型转录因子,它可以通过控制Runx2上游信号来控制骨分化。在他们的文章中,他们在多功小鼠骨髓细胞和原代小鼠间充质干细胞上利用基因敲除和过表达实验验证了这些结果。”该杂志主编、韦恩州立大学医学院的Graham C. Parker博士这样说道。
8.FASEB J:静态磁场可以促进3D打印的钛支架介导的骨修复
doi:10.1096/fj.201802195R
自从2016年发现3D打印(3DP)的多孔钛支架以来,科学界一直在探索提高它们刺激骨生成或者骨重塑能力的方法。近日一项发表在《The FASEB Journal》上的文章发现使用静态磁场(Static Magnetic Field,SMF)刺激3DP支架可以在体内外激活人骨来源的间充质干细胞(human bone-derived mesenchymal stem cells,hBMSCs)的成骨潜力。
研究人员使用hBMSCs和动物模型进行了相关实验。他们将hBMSCs植入到3DP支架表面之后,将细胞分为了4组,第一组作为对照组。随后他们将剩下的三组分别暴露在磁场强度为50、100、150毫特斯拉(milliTesla,mT)的磁场中,并在接下来14天持续观察这些细胞。研究人员发现SMF刺激的细胞成骨潜力显著高于对照组。此外,研究人员还发现磁场强度越大,成骨能力越强。
为了进行动物实验,研究人员创造了一个骨缺陷的大鼠模型。将大鼠分为两组后,研究人员将第一组作为对照组,将第二组暴露在100 mT的SMF中。12周后,研究人员发现SMF处理的大鼠生成了更多的新骨组织。
9.PNAS:弹性蛋白原或能促进干细胞生长 有望加速新型干细胞疗法的开发
doi:10.1073/pnas.1812951116
近日,一项刊登在国际杂志Proceedings of the National Academy of Sciences上的研究报告中,来自悉尼大学的科学家们通过研究发现,一种用于制造弹性外科凝胶剂(胶水)的原料—弹性蛋白原(tropoelastin)或能促进干细胞生长并帮助机体进行自我修复。干细胞能帮助机体修复并组建包括皮肤和肌肉等多种人体组织,多年以来研究人员一直在寻找新方法让干细胞能够更好地发挥作用,但并未取得显著的成果。

图片来源:University of Sydney
这项研究中,研究人员开发了一种新方法,即利用弹性蛋白原就能快速廉价地产生更多干细胞,弹性蛋白原能赋予活体组织伸展和收缩的能力;研究者表示,这种新方法能够快速有效地促进间质干细胞生长和补充。Giselle Yeo博士解释道,如今越来越多的科学家开始利用干细胞开发新型细胞疗法治疗一系列利用常规疗法无法治疗的人类疾病,包括骨骼组织损伤、心脏病、退行性疾病和器官衰竭等。但很不幸的是,由于干细胞供应不足,基于干细胞的细胞疗法的广泛应用受到了明显的抑制。
本文中研究者所开发的方法能够明显降低当前许多细胞疗法的高额成本,研究者表示,利用来自供体机体的干细胞研究发现,当施加少量的弹性蛋白原时,其就能促进更多的细胞产生,相比在干细胞培养过程中添加蛋白质而言,弹性蛋白原能够制造一种促进干细胞生长增殖的绝佳环境。干细胞常常需要一个生存和增殖的环境,如果能创造一个干细胞生长所需的良好环境,那么研究者就有望获得大量干细胞,而弹性蛋白原就能够完成这一目标。
下一步研究人员还将继续深入研究检测弹性蛋白原在人类机体中的作用效率,研究者希望,利用这种方法制造出的干细胞能够帮助机体修复损伤,并促进其它细胞移动至损伤区域,更好地促进机体进行自我修复。
10.Cell Rep:中科院和北大合作发现治疗关节炎的新靶标
doi:10.1016/j.celrep.2019.02.088
衰老是骨关节炎(osteoarthritis, OA)的一个风险因素,这是一种以关节软骨降解导致疼痛和残疾为特点的慢性疾病。研究人员已经从OA患者关节组织中分离出衰老间充质干细胞(Senescent mesenchymal stem cells,hMSCs)。而hMSCs是一个针对组织退化的重要治疗靶标。
经过4年的研究之后,来自中国科学院动物研究所、北京大学生物物理研究所的科学家们在《Cell Reports》上报道了他们的研究成果,他们发现蛋白因子CBX4可以帮助治疗小鼠的OA。科学家们发现CBX4可以通过调节核仁结构和功能来保护hMSCs不衰老。重要的是CBX4过表达可以缓解小鼠OA的发展,这表明CBX4是一个可以靶向干预的治疗靶点。
CBX4是核心蛋白复合体PRC1(Polycomb repressive complex 1)的一个组成部分,通过基因沉默在调节细胞身份和器官发育中扮演关键角色。衰老的hMSCs中的CBX4被下调,而敲除hMSCs中的CBX4会导致核仁异染色质不稳定,增强核糖体生物的发生,增加蛋白质翻译,加速细胞衰老。
CBX4通过将核仁蛋白——纤溶蛋白和异染色质蛋白KRAB相关蛋白1(KRAB-associated protein 1,KAP1)招募到核仁rDNA上,限制过量rRNAs的表达。CBX4的过表达可以消除hMSCs生理衰老并减缓小鼠OA的发展。这些发现不仅强调了CBX4介导的核仁稳定性对于防止hMSCs衰老的重要性,还为防止衰老相关干细胞衰竭提供了新方法,有望用于治疗衰老相关疾病。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


