2019年4月25日世界疟疾日,盘点疟疾领域研究进展
来源:本站原创 2019-04-25 22:26
2019年4月25日讯/生物谷BIOON/---疟疾是经按蚊叮咬或输入带疟原虫者的血液而感染疟原虫所引起的虫媒传染病。寄生于人体的疟原虫共有五种,即间日疟原虫,三日疟原虫,恶性疟原虫、卵形疟原虫和诺氏疟原虫。一旦疟原虫通过蚊子叮咬进入人体,它们先在肝脏中增殖,随后侵入红细胞,在那里,它们导致所有的疟疾症状。疟疾能通过受感染的蚊虫叮咬传播,影响了世界上97个国家和地区。疟疾每年会杀死约500000人
2019年4月25日讯/生物谷BIOON/---疟疾是经按蚊叮咬或输入带疟原虫者的血液而感染疟原虫所引起的虫媒传染病。寄生于人体的疟原虫共有五种,即间日疟原虫,三日疟原虫,恶性疟原虫、卵形疟原虫和诺氏疟原虫。一旦疟原虫通过蚊子叮咬进入人体,它们先在肝脏中增殖,随后侵入红细胞,在那里,它们导致所有的疟疾症状。疟疾能通过受感染的蚊虫叮咬传播,影响了世界上97个国家和地区。
疟疾每年会杀死约500000人,主要在撒哈拉以南非洲及南太平洋的热带国家。据统计,2015年疟疾感染了超过2亿人,杀死了约438000人,其中大部分为非洲的儿童。尽管这些数字看起来很庞大,但在与过去的15年的数据对比后,你会发现情况已经有了明显的好转。与2000年相比,蚊帐和杀虫剂的使用已经使得疟疾发病率降低了22%,同时,死亡率也降低了一半。世界卫生组织的全球技术战略针对疟疾设立了一个目标:在2020年前,要在至少十个国家彻底消灭疟疾,同时在其它流行疟疾的国家要将发病率降低40%。

每年4月25日是世界疟疾日(World Malaria Day,也称世界防治疟疾日),世界疟疾日由世界卫生大会在2007年5月第六十届会议上设立,旨在推动全球进行疟疾防治。2019年世界疟疾日主题是“零疟疾从我开始(Zero Malaria Starts With Me)”。2019年4月26日是我国第12个“全国疟疾日”。为落实奋力推进健康中国建设总体要求,实现2020年消除疟疾目标,进一步提高社会和公众的疟疾防控意识,今年“全国疟疾日”宣传主题是“消除疟疾,谨防境外输入再传播”。
疟疾被认为是最致命的疾病之一,是现代社会的一大威胁。想要"消灭"疟疾,我们还有很长的路要走。基于此,小编针对近年来疟疾研究取得的进展进行一番盘点,以飨读者。
1.AAC:抗疟疾实验性药物在人类临床试验中展现出巨大潜力
doi:10.1128/AAC.01837-18
研究者指出,通过在之前并未接触过恶性疟原虫的健康受试者机体中进行实验诱导使其发生血液感染,感染后连续给药7天,研究者发现,口服单一剂量的药物DSM26 400毫克就足以清除机体中低水平的恶性疟原虫寄生虫血症;本文研究首次证实了100多项此前研究的结果,即药物DSM265能从感染者机体中清除致病性的非性阶段寄生虫。
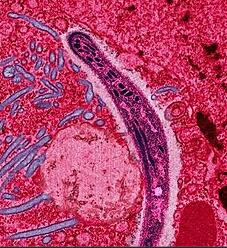
当前患者能采取三天的联合药物疗法治愈疟疾,研究者Jorg Mohrle博士说道,单一剂量疗法或能能提供一种全新的治疗手段,其能提高患者的依从性,降低药物耐受性的发生,并帮助最终有效根除这种疾病。DSM265疗法就有望成为这种单一剂量疗法,尽管目前无法有效 清除处于性阶段的寄生虫(即配子母细胞),但清除无性阶段的寄生虫却是一种治疗方法,配子细胞并不会致病,而且其也无法在人类机体中完成整个生命周期。<
2.Nature:抗疟疾新思路!用药物覆盖蚊帐杀灭蚊子体内的疟原虫!
doi:10.1038/s41586-019-0973-1
近日,一项刊登在国际杂志Nature上的研究报告中,来自弗吉尼亚理工大学的科学家们通过研究开发了一种新技术来预防甚至降低额外的疟疾死亡人数;研究者表示,他们能利用阿托伐醌(atovaquone)来治疗疟原虫感染,当一个人生病时,用该药物来覆盖蚊帐,并让 蚊子摄入抗疟疾药物,就好比是药物“治愈”了蚊子,因此其就无法传播疾病了。
那么如何让这种药物进入到蚊子体内呢?研究者利用药物来覆盖蚊帐,文章中研究者开发了一种新型的计算机模型,其能帮助分析如何将阿托伐醌加入到蚊帐上,并利用这种方法来治愈被在人群中流行的疟原虫感染的蚊子;研究人员能够在多种外部条件下进行模拟,比 如当前的疟疾流行状况下、蚊帐的覆盖率以及杀虫剂的耐药性水平等。
研究者发现,当蚊子在布满药物的蚊帐上停留6分钟时间,其机体就会吸收足以杀灭体内疟原虫的药物剂量,这种方法非常有效,且不会对疟疾高度流行区的环境和人群造成太大伤害,同时其与当前多项技术相比还拥有很多优点;研究者Childs说道,蚊子并不会对这种化 合物产生耐药性,因为药物化合物仅仅杀灭了蚊子体内的疟原虫,而且阿托伐醌是已经获批能安全用于人体的药物。
3.EMBO Mol Med:新研究揭示脑疟疾的致病机制
doi:10.15252/emmm.201809164
最近,研究者们首次提供证据证明大脑血管中的红细胞感染疟疾会造成临床上的脑疟疾综合征。
脑疟疾是一种危及生命的并发症,主要原因是血红细胞感染了恶性疟原虫(Plasmodium falciparum)。这种并发症的特征在于寄生虫感染的红细胞在脑中累积。
最近发表在《EMBO molecular medicine》杂志上的第一作者Janet Storm博士解释说:“很少有人知道为什么这种严重的并发症只发生在某些孩子中。但是,被感染的红细胞在其表面上呈现一种叫做恶性疟原虫红细胞膜蛋白1(PfEMP1)的蛋白质,使之能够与许多器官(包括大脑)血管内的宿主细胞结合。PfEMP1蛋白的性质是可变的,其导致感染的红细胞结合脑中宿主细胞的能力发生变化。这被认为是我们仅在一些感染者中看到脑疟疾的原因,并且如果被感染的红细胞不进入大脑,则不会发生脑疟疾。”

在该研究中,作者利用基于流动的粘附分析来研究大脑或无并发症疟疾患儿的感染红细胞与人脑血管细胞的结合情况。该团队还使用分子技术研究受感染的红细胞表达的PfEMP1的情况。
结果显示,患有脑疟疾的患者感染的红细胞与脑源性细胞的结合高于无并发症的疟疾患者。这表明,在大多数情况下,恶性疟原虫避免靶向脑,并且仅当红细胞表达具有特定粘附表型的PfEMP1蛋白亚组时才发生脑疟疾,所述粘附表型允许有效结合脑血管。知道大脑中的结合是脑疟疾的一个关键特征,研究人员可以根据受感染的红细胞与大脑血管内的宿主细胞之间的相互作用,将注意力集中在开发新的严重疾病干预措施上。
4.Nature:科学家成功捕获恶性疟原虫感染红细胞的关键复合体结构 有望开发出新型疟疾疫苗
doi:10.1038/s41586-018-0779-6
近日,一项刊登在国际杂志Nature上的研究报告中,来自霍华德休斯敦医学院的科学家们通过研究成功观察到恶性疟原虫进入并感染人类红细胞所使用的特殊关键分子的清晰结构,相关研究结果或能帮助研究人员设计新型疫苗来抵御流行性疟原虫的感染。本文研究具有重大意义,因为疟原虫每年在全球会引发50多万人死亡,而且目前并没有有效的疫苗来抵御疟疾的感染。
研究人员通过对样本中的疟原虫DNA进行遗传工程化修饰,并提取Rh5和CyRPA两种蛋白质,同时结合生物技术公司ExpreS2ion所开发的第三种蛋白质Ripr进行联合研究;研究者Wong说道,利用冷冻电子显微镜技术我们就能够观察到Rh5/CyRPA/Ripr三种蛋白复合体的3-D图像信息,同时我们还能从不同的角度来获得多种复合体成像结构。
在高性能计算技术的帮助下,研究人员还能将上述图像信息组合起来,首次揭示了一种高分辨率的Rh5/CyRPA/Ripr复合体3-D成像信息,相关信息对于疟原虫引发感染至关重要。
5.Science:新研究有助于杀死肝脏中的疟原虫
doi:10.1126/science.aat9446; doi:10.1126/science.aav7479
在持续寻找更有效的抗疟疾武器的过程中,国际研究人员周四表示他们正在探索一条迄今为止尚未研究的途径 - 在疾病出现之前,在肝脏中杀死寄生虫。在最近发表在“科学”杂志上的最新研究中,科学家们解剖了数十万只蚊子,以清除它们内部的寄生虫。之后,作者将每个寄生虫在管中分离并用不同的化合物处理 - 总共500,000个实验。研究人员发现某些分子能够杀死寄生虫。
经过大约六年的工作,已经确定了631种用于“化学疫苗”的候选分子 - 一种允许身体产生抗体的正常疫苗。现在,研究人员需要确认所识别的631种分子中哪一种能够真正消灭这种全球性的祸害。
6.PNAS:疟疾与糖代谢之间的关系?
doi:10.1073/pnas.1806376115
每年有超过一百万人死于脑疟疾,这是疟疾中最致命的形式。最近由耶鲁大学研究人员领导的一项研究探讨了葡萄糖代谢在疟疾疾病发展中的作用,这一发现可能成为预防或治疗人类疾病的关键。

研究小组利用脑疟疾的小鼠模型,尝试了不同的喂养方式对于小鼠患病的影响。根据他们在之前的一项研究中的发现,他们推测,减少食物摄入量 - 特别是降低葡萄糖利用率 -会增加小鼠感染疟疾的耐受能力。
为了阻断细胞中葡萄糖的摄取,他们用称为2DG的葡萄糖抑制剂治疗感染的小鼠。这种干预措施能够保护小鼠免于发生脑疟疾,使其存活期增加数天。通过进一步检查,研究人员观察到2DG通过降低大脑中的凝血效应来保护小鼠。
用2DG阻断葡萄糖代谢,进而降低疟疾引起血液凝结效应,从而帮助动物耐受与大脑的感染相关的损伤。这种保护作用使小鼠既能耐受大脑感染的附带损害,又能抵抗抗生素治疗后的寄生虫。研究人员表示,这一发现表明2DG可能在治疗脑疟疾的早期阶段发挥作用。
7.PLoS Pathog:疟疾感染如何激活NK细胞
doi:10.1371/journal.ppat.1007298
根据最近南洋理工大学和麻省理工学院的研究者们在开放获取期刊PLOS Pathogens发表的一项研究,疟疾感染后的红细胞通过释放激活病原体识别受体MDA5的小囊泡激活免疫系统的第一道防线。
疟疾是由属于疟原虫属的寄生微生物引起的主要公共卫生问题。更好地了解早期宿主反应和免疫决定因素对于开发创新治疗方法至关重要。自然杀伤细胞(NK)是重要的免疫细胞,它们提供抵抗疟疾感染的第一道防线,但在不同个体NK细胞抵抗疟疾感染的反应性显示出显着差异。NK细胞被寄生虫激活的分子机制在很大程度上是未知的,NK细胞对人群中疟疾感染的反应变化的分子基础也并没有得到清除的揭示。为了解决这一问题,作者等人分析了不同人NK细胞的转录差异,以及这些细胞对疟疾感染的反应程度。
对疟原虫感染的红细胞有反应的自然杀伤细胞具有更高水平的MDA5,其被感染细胞释放的小囊泡激活。研究结果表明,MDA5可能导致NK细胞对人群中疟疾感染的反应变化。此外,该研究为NK细胞被寄生虫激活的机制提供了新的见解,并揭示了控制人类疟疾感染的可能分子靶点。
8.Nat Commun:抗癌药联合青蒿素,双管齐下攻克耐药疟原虫!
doi:10.1038/s41467-018-06221-1
根据一项最新发表在《Nature Communications》上的研究,科学家们已经找到了一种使用化疗药物显著增强世界上最有效的抗疟疾药物疗效的方法。来自墨尔本大学和日本药企Takeda的科学家们发现抗疟疾药物青蒿素是通过一种双重作用攻击致命疟原虫来发挥疗效的。这个药物会损伤疟原虫表面的蛋白质,堵塞疟原虫的废物处理系统——蛋白酶体。
墨尔本大学疟疾研究专家Leann Tilley说道:“双重杀伤效应意味着将青蒿素和另一种靶向蛋白酶体的抗癌化疗药物联合使用以增强青蒿素的活性,可以有效恢复青蒿素对抗青蒿素耐受性病原体的能力。”
“这种寄生虫的蛋白酶体就像一台碎纸机,可以将受损或无用的蛋白质撕碎。”Tilley说道。“使用青蒿素治疗疟疾寄生虫会使之产生很多损坏的蛋白质。青蒿素和蛋白酶体抑制剂可以联合起来阻止这条通路。”抑制蛋白酶体可以使损坏的蛋白质堆积,这是死亡之吻的标志之一。但这些损坏蛋白质堆积之后,它们可以给寄生虫施加压力,最终导致它们死亡。
9.Sci Rep:计算机模拟能够预测疟疾的最新表型
doi:10.1038/s41598-018-31320-w
由ISGlobal和牛津大学研究员Climent Casals-Pascual领导的团队应用基于网络的计算分析,以识别除WHO目前定义的那些生物学相关表型(脑疟疾,呼吸窘迫和严重疟疾贫血)。为此,他们对近3000名因疟疾住院的冈比亚儿童的数据进行了“基于网络的聚类分析”。他们发现,具有较高表型异质性的群体的死亡率较高。分析显示四组患者均伴有呼吸窘迫和严重贫血,其中肝脏大小的增加与较高的死亡率相关。通过分析这些患者的血浆蛋白,他们发现这可能是由于心力衰竭。
“我们的结果表明,心力衰竭应该被重新考虑为严重疟疾的致病机制,”Casals-Pascual解释说,“因此,标准的临床管理可能不适合这些患者。”这种“系统方法”可以是一种非常有价值的工具,可用于识别新的表型和机制以及复杂疾病的治疗选择,“他补充说。
10.Nature:从结构上揭示疟原虫接管人红细胞的机制
doi:10.1038/s41586-018-0469-4
正常的红细胞过于简单而无法提供足够的营养物来支持活跃生长的疟原虫。侵入红细胞中的每个疟原虫就像是生活在一个空仓库中,必需产生数百种疟原虫“效应”蛋白将红细胞重塑为一个适合生长的家。疟原虫输出蛋白转运体(Plasmodium translocon of exported proteins, PTEX)是将这些疟原虫蛋白运输到红细胞中的蛋白复合物。PTEX起着门卫的作用;若没有它,这些效应蛋白就会被困在液泡中。但是迄今为止,科学家们并不知道PTEX如何参与将这些蛋白运输到红细胞中。
在一项新的研究中,来自美国加州大学洛杉矶分校和华盛顿大学医学院的研究人员在实验室中利用人血液培养疟原虫。他们从这些疟原虫中提取出PTEX,并在零下190摄氏度快速将它冻结。他们利用一种被称作低温电镜(cryoEM)的技术获得PTEX颗粒的图片。也因此,他们首次在原子水平下解析出PTEX的结构。他们发现PTEX是由三个蛋白组成的,像分子机器那样发挥作用。相关研究结果于2018年8月27日在线发表在Nature期刊上,论文标题为“Malaria parasite translocon structure and mechanism of effector export”。论文通信作者为加州大学洛杉矶分校的Z. Hong Zhou和Pascal F. Egea。论文第一作者为加州大学洛杉矶分校的Chi-Min Ho。
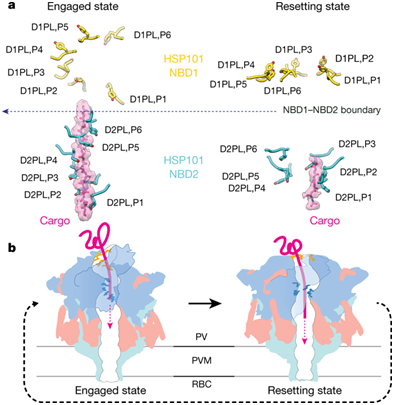
PTEX中的第一个蛋白是驱动蛋白运输的引擎;它让这些疟原虫效应蛋白解折叠,并让它们穿过PTEX中的剩余两个蛋白。位于中间的一个蛋白就像是一个适配器,将这个引擎连接到最后的一个在形状上类似于漏斗的蛋白上,从而允许将这些效应蛋白运输到红细胞中。(生物谷 Bioon.com)
疟疾每年会杀死约500000人,主要在撒哈拉以南非洲及南太平洋的热带国家。据统计,2015年疟疾感染了超过2亿人,杀死了约438000人,其中大部分为非洲的儿童。尽管这些数字看起来很庞大,但在与过去的15年的数据对比后,你会发现情况已经有了明显的好转。与2000年相比,蚊帐和杀虫剂的使用已经使得疟疾发病率降低了22%,同时,死亡率也降低了一半。世界卫生组织的全球技术战略针对疟疾设立了一个目标:在2020年前,要在至少十个国家彻底消灭疟疾,同时在其它流行疟疾的国家要将发病率降低40%。

图片来自Malariaconsortium/Wikipedia。
每年4月25日是世界疟疾日(World Malaria Day,也称世界防治疟疾日),世界疟疾日由世界卫生大会在2007年5月第六十届会议上设立,旨在推动全球进行疟疾防治。2019年世界疟疾日主题是“零疟疾从我开始(Zero Malaria Starts With Me)”。2019年4月26日是我国第12个“全国疟疾日”。为落实奋力推进健康中国建设总体要求,实现2020年消除疟疾目标,进一步提高社会和公众的疟疾防控意识,今年“全国疟疾日”宣传主题是“消除疟疾,谨防境外输入再传播”。
疟疾被认为是最致命的疾病之一,是现代社会的一大威胁。想要"消灭"疟疾,我们还有很长的路要走。基于此,小编针对近年来疟疾研究取得的进展进行一番盘点,以飨读者。
1.AAC:抗疟疾实验性药物在人类临床试验中展现出巨大潜力
doi:10.1128/AAC.01837-18
研究者指出,通过在之前并未接触过恶性疟原虫的健康受试者机体中进行实验诱导使其发生血液感染,感染后连续给药7天,研究者发现,口服单一剂量的药物DSM26 400毫克就足以清除机体中低水平的恶性疟原虫寄生虫血症;本文研究首次证实了100多项此前研究的结果,即药物DSM265能从感染者机体中清除致病性的非性阶段寄生虫。

图片来源:en.m.wikipedia.org
当前患者能采取三天的联合药物疗法治愈疟疾,研究者Jorg Mohrle博士说道,单一剂量疗法或能能提供一种全新的治疗手段,其能提高患者的依从性,降低药物耐受性的发生,并帮助最终有效根除这种疾病。DSM265疗法就有望成为这种单一剂量疗法,尽管目前无法有效 清除处于性阶段的寄生虫(即配子母细胞),但清除无性阶段的寄生虫却是一种治疗方法,配子细胞并不会致病,而且其也无法在人类机体中完成整个生命周期。<
2.Nature:抗疟疾新思路!用药物覆盖蚊帐杀灭蚊子体内的疟原虫!
doi:10.1038/s41586-019-0973-1
近日,一项刊登在国际杂志Nature上的研究报告中,来自弗吉尼亚理工大学的科学家们通过研究开发了一种新技术来预防甚至降低额外的疟疾死亡人数;研究者表示,他们能利用阿托伐醌(atovaquone)来治疗疟原虫感染,当一个人生病时,用该药物来覆盖蚊帐,并让 蚊子摄入抗疟疾药物,就好比是药物“治愈”了蚊子,因此其就无法传播疾病了。
那么如何让这种药物进入到蚊子体内呢?研究者利用药物来覆盖蚊帐,文章中研究者开发了一种新型的计算机模型,其能帮助分析如何将阿托伐醌加入到蚊帐上,并利用这种方法来治愈被在人群中流行的疟原虫感染的蚊子;研究人员能够在多种外部条件下进行模拟,比 如当前的疟疾流行状况下、蚊帐的覆盖率以及杀虫剂的耐药性水平等。
研究者发现,当蚊子在布满药物的蚊帐上停留6分钟时间,其机体就会吸收足以杀灭体内疟原虫的药物剂量,这种方法非常有效,且不会对疟疾高度流行区的环境和人群造成太大伤害,同时其与当前多项技术相比还拥有很多优点;研究者Childs说道,蚊子并不会对这种化 合物产生耐药性,因为药物化合物仅仅杀灭了蚊子体内的疟原虫,而且阿托伐醌是已经获批能安全用于人体的药物。
3.EMBO Mol Med:新研究揭示脑疟疾的致病机制
doi:10.15252/emmm.201809164
最近,研究者们首次提供证据证明大脑血管中的红细胞感染疟疾会造成临床上的脑疟疾综合征。
脑疟疾是一种危及生命的并发症,主要原因是血红细胞感染了恶性疟原虫(Plasmodium falciparum)。这种并发症的特征在于寄生虫感染的红细胞在脑中累积。
最近发表在《EMBO molecular medicine》杂志上的第一作者Janet Storm博士解释说:“很少有人知道为什么这种严重的并发症只发生在某些孩子中。但是,被感染的红细胞在其表面上呈现一种叫做恶性疟原虫红细胞膜蛋白1(PfEMP1)的蛋白质,使之能够与许多器官(包括大脑)血管内的宿主细胞结合。PfEMP1蛋白的性质是可变的,其导致感染的红细胞结合脑中宿主细胞的能力发生变化。这被认为是我们仅在一些感染者中看到脑疟疾的原因,并且如果被感染的红细胞不进入大脑,则不会发生脑疟疾。”

图片来源:Emily Lund, Harvard University's T.H. Chan School of Public Health。
在该研究中,作者利用基于流动的粘附分析来研究大脑或无并发症疟疾患儿的感染红细胞与人脑血管细胞的结合情况。该团队还使用分子技术研究受感染的红细胞表达的PfEMP1的情况。
结果显示,患有脑疟疾的患者感染的红细胞与脑源性细胞的结合高于无并发症的疟疾患者。这表明,在大多数情况下,恶性疟原虫避免靶向脑,并且仅当红细胞表达具有特定粘附表型的PfEMP1蛋白亚组时才发生脑疟疾,所述粘附表型允许有效结合脑血管。知道大脑中的结合是脑疟疾的一个关键特征,研究人员可以根据受感染的红细胞与大脑血管内的宿主细胞之间的相互作用,将注意力集中在开发新的严重疾病干预措施上。
4.Nature:科学家成功捕获恶性疟原虫感染红细胞的关键复合体结构 有望开发出新型疟疾疫苗
doi:10.1038/s41586-018-0779-6
近日,一项刊登在国际杂志Nature上的研究报告中,来自霍华德休斯敦医学院的科学家们通过研究成功观察到恶性疟原虫进入并感染人类红细胞所使用的特殊关键分子的清晰结构,相关研究结果或能帮助研究人员设计新型疫苗来抵御流行性疟原虫的感染。本文研究具有重大意义,因为疟原虫每年在全球会引发50多万人死亡,而且目前并没有有效的疫苗来抵御疟疾的感染。
研究人员通过对样本中的疟原虫DNA进行遗传工程化修饰,并提取Rh5和CyRPA两种蛋白质,同时结合生物技术公司ExpreS2ion所开发的第三种蛋白质Ripr进行联合研究;研究者Wong说道,利用冷冻电子显微镜技术我们就能够观察到Rh5/CyRPA/Ripr三种蛋白复合体的3-D图像信息,同时我们还能从不同的角度来获得多种复合体成像结构。
在高性能计算技术的帮助下,研究人员还能将上述图像信息组合起来,首次揭示了一种高分辨率的Rh5/CyRPA/Ripr复合体3-D成像信息,相关信息对于疟原虫引发感染至关重要。
5.Science:新研究有助于杀死肝脏中的疟原虫
doi:10.1126/science.aat9446; doi:10.1126/science.aav7479
在持续寻找更有效的抗疟疾武器的过程中,国际研究人员周四表示他们正在探索一条迄今为止尚未研究的途径 - 在疾病出现之前,在肝脏中杀死寄生虫。在最近发表在“科学”杂志上的最新研究中,科学家们解剖了数十万只蚊子,以清除它们内部的寄生虫。之后,作者将每个寄生虫在管中分离并用不同的化合物处理 - 总共500,000个实验。研究人员发现某些分子能够杀死寄生虫。
经过大约六年的工作,已经确定了631种用于“化学疫苗”的候选分子 - 一种允许身体产生抗体的正常疫苗。现在,研究人员需要确认所识别的631种分子中哪一种能够真正消灭这种全球性的祸害。
6.PNAS:疟疾与糖代谢之间的关系?
doi:10.1073/pnas.1806376115
每年有超过一百万人死于脑疟疾,这是疟疾中最致命的形式。最近由耶鲁大学研究人员领导的一项研究探讨了葡萄糖代谢在疟疾疾病发展中的作用,这一发现可能成为预防或治疗人类疾病的关键。

图片来源:www.pixabay.com。
研究小组利用脑疟疾的小鼠模型,尝试了不同的喂养方式对于小鼠患病的影响。根据他们在之前的一项研究中的发现,他们推测,减少食物摄入量 - 特别是降低葡萄糖利用率 -会增加小鼠感染疟疾的耐受能力。
为了阻断细胞中葡萄糖的摄取,他们用称为2DG的葡萄糖抑制剂治疗感染的小鼠。这种干预措施能够保护小鼠免于发生脑疟疾,使其存活期增加数天。通过进一步检查,研究人员观察到2DG通过降低大脑中的凝血效应来保护小鼠。
用2DG阻断葡萄糖代谢,进而降低疟疾引起血液凝结效应,从而帮助动物耐受与大脑的感染相关的损伤。这种保护作用使小鼠既能耐受大脑感染的附带损害,又能抵抗抗生素治疗后的寄生虫。研究人员表示,这一发现表明2DG可能在治疗脑疟疾的早期阶段发挥作用。
7.PLoS Pathog:疟疾感染如何激活NK细胞
doi:10.1371/journal.ppat.1007298
根据最近南洋理工大学和麻省理工学院的研究者们在开放获取期刊PLOS Pathogens发表的一项研究,疟疾感染后的红细胞通过释放激活病原体识别受体MDA5的小囊泡激活免疫系统的第一道防线。
疟疾是由属于疟原虫属的寄生微生物引起的主要公共卫生问题。更好地了解早期宿主反应和免疫决定因素对于开发创新治疗方法至关重要。自然杀伤细胞(NK)是重要的免疫细胞,它们提供抵抗疟疾感染的第一道防线,但在不同个体NK细胞抵抗疟疾感染的反应性显示出显着差异。NK细胞被寄生虫激活的分子机制在很大程度上是未知的,NK细胞对人群中疟疾感染的反应变化的分子基础也并没有得到清除的揭示。为了解决这一问题,作者等人分析了不同人NK细胞的转录差异,以及这些细胞对疟疾感染的反应程度。
对疟原虫感染的红细胞有反应的自然杀伤细胞具有更高水平的MDA5,其被感染细胞释放的小囊泡激活。研究结果表明,MDA5可能导致NK细胞对人群中疟疾感染的反应变化。此外,该研究为NK细胞被寄生虫激活的机制提供了新的见解,并揭示了控制人类疟疾感染的可能分子靶点。
8.Nat Commun:抗癌药联合青蒿素,双管齐下攻克耐药疟原虫!
doi:10.1038/s41467-018-06221-1
根据一项最新发表在《Nature Communications》上的研究,科学家们已经找到了一种使用化疗药物显著增强世界上最有效的抗疟疾药物疗效的方法。来自墨尔本大学和日本药企Takeda的科学家们发现抗疟疾药物青蒿素是通过一种双重作用攻击致命疟原虫来发挥疗效的。这个药物会损伤疟原虫表面的蛋白质,堵塞疟原虫的废物处理系统——蛋白酶体。
墨尔本大学疟疾研究专家Leann Tilley说道:“双重杀伤效应意味着将青蒿素和另一种靶向蛋白酶体的抗癌化疗药物联合使用以增强青蒿素的活性,可以有效恢复青蒿素对抗青蒿素耐受性病原体的能力。”
“这种寄生虫的蛋白酶体就像一台碎纸机,可以将受损或无用的蛋白质撕碎。”Tilley说道。“使用青蒿素治疗疟疾寄生虫会使之产生很多损坏的蛋白质。青蒿素和蛋白酶体抑制剂可以联合起来阻止这条通路。”抑制蛋白酶体可以使损坏的蛋白质堆积,这是死亡之吻的标志之一。但这些损坏蛋白质堆积之后,它们可以给寄生虫施加压力,最终导致它们死亡。
9.Sci Rep:计算机模拟能够预测疟疾的最新表型
doi:10.1038/s41598-018-31320-w
由ISGlobal和牛津大学研究员Climent Casals-Pascual领导的团队应用基于网络的计算分析,以识别除WHO目前定义的那些生物学相关表型(脑疟疾,呼吸窘迫和严重疟疾贫血)。为此,他们对近3000名因疟疾住院的冈比亚儿童的数据进行了“基于网络的聚类分析”。他们发现,具有较高表型异质性的群体的死亡率较高。分析显示四组患者均伴有呼吸窘迫和严重贫血,其中肝脏大小的增加与较高的死亡率相关。通过分析这些患者的血浆蛋白,他们发现这可能是由于心力衰竭。
“我们的结果表明,心力衰竭应该被重新考虑为严重疟疾的致病机制,”Casals-Pascual解释说,“因此,标准的临床管理可能不适合这些患者。”这种“系统方法”可以是一种非常有价值的工具,可用于识别新的表型和机制以及复杂疾病的治疗选择,“他补充说。
10.Nature:从结构上揭示疟原虫接管人红细胞的机制
doi:10.1038/s41586-018-0469-4
正常的红细胞过于简单而无法提供足够的营养物来支持活跃生长的疟原虫。侵入红细胞中的每个疟原虫就像是生活在一个空仓库中,必需产生数百种疟原虫“效应”蛋白将红细胞重塑为一个适合生长的家。疟原虫输出蛋白转运体(Plasmodium translocon of exported proteins, PTEX)是将这些疟原虫蛋白运输到红细胞中的蛋白复合物。PTEX起着门卫的作用;若没有它,这些效应蛋白就会被困在液泡中。但是迄今为止,科学家们并不知道PTEX如何参与将这些蛋白运输到红细胞中。
在一项新的研究中,来自美国加州大学洛杉矶分校和华盛顿大学医学院的研究人员在实验室中利用人血液培养疟原虫。他们从这些疟原虫中提取出PTEX,并在零下190摄氏度快速将它冻结。他们利用一种被称作低温电镜(cryoEM)的技术获得PTEX颗粒的图片。也因此,他们首次在原子水平下解析出PTEX的结构。他们发现PTEX是由三个蛋白组成的,像分子机器那样发挥作用。相关研究结果于2018年8月27日在线发表在Nature期刊上,论文标题为“Malaria parasite translocon structure and mechanism of effector export”。论文通信作者为加州大学洛杉矶分校的Z. Hong Zhou和Pascal F. Egea。论文第一作者为加州大学洛杉矶分校的Chi-Min Ho。

图片来自Nature, doi:10.1038/s41586-018-0469-4。
PTEX中的第一个蛋白是驱动蛋白运输的引擎;它让这些疟原虫效应蛋白解折叠,并让它们穿过PTEX中的剩余两个蛋白。位于中间的一个蛋白就像是一个适配器,将这个引擎连接到最后的一个在形状上类似于漏斗的蛋白上,从而允许将这些效应蛋白运输到红细胞中。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


