Nature综述:新一代“智能”CAR-T疗法装了哪些武器?
来源:药明康德 2019-04-18 12:25
在癌症免疫疗法领域,免疫检查点抑制剂和CAR-T疗法无疑是改变癌症治疗模式的两大突破。然而,免疫检查点抑制剂已经可以用于治疗多种癌症类型,而CAR-T疗法的适应症却屈指可数。CAR-T疗法虽然在治疗B细胞血液癌症方面表现出卓越的疗效,然而治疗其它类型癌症的CAR-T疗法还迟迟未能诞生。究其根源,CAR-T疗法的设计和开发需要克服三大挑战:缺少理想的肿瘤抗原作为靶点,肿瘤介导的免疫抑制,
在癌症免疫疗法领域,免疫检查点抑制剂和CAR-T疗法无疑是改变癌症治疗模式的两大突破。然而,免疫检查点抑制剂已经可以用于治疗多种癌症类型,而CAR-T疗法的适应症却屈指可数。CAR-T疗法虽然在治疗B细胞血液癌症方面表现出卓越的疗效,然而治疗其它类型癌症的CAR-T疗法还迟迟未能诞生。
究其根源,CAR-T疗法的设计和开发需要克服三大挑战:缺少理想的肿瘤抗原作为靶点,肿瘤介导的免疫抑制,和CAR-T疗法的严重毒副作用。那么,用什么方法可以克服这三大挑战,提高CAR-T疗法的效果并拓宽其应用范围呢?
日前,麻省理工学院(MIT)著名跨界学者卢冠达(Timothy Lu)博士在《Nature Reviews Cancer》上发表文章,介绍了使用合成生物学构建新一代“智能”CAR-T疗法的最新进展。80后的卢冠达博士是MIT电子工程、计算机科学和生物工程系教授,也是Senti Biosciences、Tango Therapeutics和Synlogic等多家生物技术公司的创始人。今天,药明康德微信团队将和读者一起分享这篇文章中的精彩内容。
使用基因回路让两种抗原控制CAR-T细胞的激活
CAR-T细胞疗法首先从患者体内收集T细胞,然后通过基因工程在T细胞表面表达嵌合抗原受体(CAR)。这是一种融合蛋白,它的细胞外蛋白域是一个识别肿瘤表面抗原的单链可变区片段(scFv),而细胞内蛋白域包含了T细胞受体(TCR)和相关共刺激受体的细胞内蛋白域。这些CAR-T细胞然后被输回患者体内,它们可以识别和消灭表达指定抗原的肿瘤细胞。
目前,已有两种CAR-T疗法获得FDA批准,它们在治疗B细胞血癌方面疗效突出。然而,目前获批的CAR-T疗法都只能识别一种抗原。发现一个能够特异性标记肿瘤细胞的肿瘤表面抗原是一个巨大的挑战,这也是限制CAR-T疗法广泛应用的原因之一。
例如,靶向CD19的CAR-T细胞能够有效治疗B细胞血癌,然而因为CD19也表达在正常B细胞表面,这类疗法也会消灭正常B细胞,从而导致B细胞发育不全。虽然靶向CD19的CAR-T疗法的这一副作用通常不会致命,而且可以通过静脉输入免疫球蛋白来进行治疗,然而,在靶向其它抗原时,患者可能无法耐受CAR-T细胞对正常细胞的杀伤。
合成化学力图使用工程学的理论来改造活细胞,通过在细胞中加入基因电路(gene circuits),让它们能够感知外来信号并且作出简单的逻辑决策。比如,在设计新一代CAR-T细胞方面,依靠多种抗原来区分肿瘤细胞和正常细胞,将可以让CAR-T更为精确靶向肿瘤,并且更具有适应性。
例如,合成生物学可以设计出一种T细胞,它必须识别肿瘤表面表达的两种抗原才会被激活。这一设计可以通过人工合成的Notch受体(synNotch)来实现。synNotch受体在与肿瘤表面的特定抗原A结合后,通过释放转录因子,能够激发CAR-T细胞表达靶向第二个抗原B的CAR。在这种情况下,CAR-T细胞只有在接触到抗原A,再接触到抗原B的时候才会被激活。
这一synNotch技术最初由加州大学旧金山分校的Wendell Lim博士率领的团队开发,并且在动物实验中得到验证。Lim博士共同创建了名为Cell Design Labs的公司来转化这一技术。在2017年12月,吉利德科学旗下的Kite Pharmaceuticals公司以可高达5.67亿美元的数额收购了Cell Design Labs,将这一技术纳入该公司的CAR-T开发平台。
而在位于纽约的纪念斯隆-凯特琳癌症中心(MSKCC),Michel Sadelain博士领导的团队设计出了同样依靠两种不同抗原的另一类CAR-T疗法。这一设计利用在正常细胞表面表达的抗原,抑制CAR-T细胞的功能。在这种设计中,CAR-T细胞表面表达着两种不同的CAR,一种是激活性CAR,它与肿瘤表面表达的特定抗原A的结合能够激活T细胞。而另一种是抑制性CAR(iCAR),它将靶向正常细胞表面表达的抗原B的抗体与免疫检查点蛋白CTLA-4或PD-1受体的细胞内域融合在一起。这种iCAR在与抗原结合后能够抑制T细胞的激活。当表达两种CAR的T细胞同时接触到两种抗原时,抑制性CAR会抑制激活性CAR的作用。所以,这种CAR-T细胞只有在接触到肿瘤特异性抗原A,但是不接触到正常细胞中表达的自体抗原B时才会被激活。
接受CAR-T疗法治疗的肿瘤会通过降低靶向抗原的表达来逃避CAR-T细胞的攻击。例如,很大一部分接受抗CD19 CAR-T细胞疗法的患者出现癌症复发的原因是肿瘤细胞丢失了CD19抗原的表达。因此,设计能够识别在肿瘤细胞上表达的多种抗原的CAR-T系统可能让CAR-T细胞的功能更为全面,防止因为抗原丢失导致的癌症复发。
通过注入两种靶向不同肿瘤抗原的CAR-T疗法,或者在同一T细胞上表达两种不同CAR,可以实现同时识别肿瘤上的两种抗原。而最新的研究方向是在一个CAR的细胞外蛋白域中纳入两个靶向不同抗原的scFvs,生成一个双特异性CAR。例如,靶向CD19和CD20的双特异性CAR已经在动物试验中防止CD19阴性的肿瘤复发。而靶向CD19和CD22的双特异性CAR-T疗法也表现出良好的临床前活性。
使用药物精确调控CAR-T细胞的活性
目前,在将CAR-T细胞输回患者体内后,如何调控免疫反应的强度是一个难题。例如,与CAR-T疗法相关的严重副作用包括细胞因子释放综合征和神经毒性。这些毒副作用产生的原因是,将CAR-T细胞输回患者体内后,我们缺乏有效的手段来控制CAR-T细胞的增殖、活性和在体内的分布。
为了更精准地控制CAR-T细胞的数量和活性,研究人员已经开发出能够促发CAR-T细胞“自杀”的安全开关。以Bellicum Pharmaceuticals公司开发的CaspaCIDe技术为例,研究人员在CAR-T细胞中加入了一个能够被名为rimiducid的小分子药物激活的胱天蛋白酶9(Caspase 9)融合蛋白。激活胱天蛋白酶9能够导致CAR-T细胞发生细胞凋亡,从而终止过度的CAR-T细胞活性。这一安全系统已经被纳入该公司的主打通用型T细胞产品rivogenlecleucel中。在人体试验中,它能够在注入药物30分钟之内就启动细胞凋亡。
而另一种通过药物来对CAR-T细胞活性进行微调的设计方式是,让CAR的最初状态处于未激活状态,只有在抗原和其它调控药物存在的情况下才能够被激活。Bellicum公司的GoCAR-T技术让CAR的共刺激受体部分受到rimiducid的调控,只有在CAR-T细胞与肿瘤抗原蛋白接触,并且接受rimiducid治疗时,CAR-T细胞才能够被激活。该公司目前将这一技术用于治疗实体瘤的CAR-T产品BPX-601中,目前它已经进入临床期开发,在1/2期临床试验中接受检验。
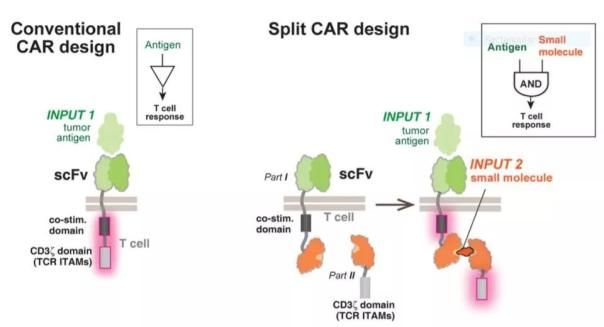
而上面提到过的UCSF的Wendell Lim博士的研究团队采用另外一种设计用药物激活CAR-T细胞活性。他们将传统的嵌合抗原受体分为两个部分,只有在这两个部分被药物连接起来后,CAR才能够激活下游信号通路,引起免疫反应。
克服肿瘤免疫抑制微环境的障碍
CAR-T疗法治疗实体瘤需要克服的一个重要挑战是肿瘤微环境介导的免疫抑制。它可能抑制T细胞的运输和激活,导致虽然CAR-T细胞能够识别肿瘤抗原,但是仍然不能够有效行使它的免疫功能。解决这一挑战的策略之一是为CAR-T细胞武装上新的“武器”,例如让它们表达免疫刺激因子IL-12,IL-15或者CD40L。
例如,MSKCC的Renier J. Brentjens博士率领的研究团队通过让CAR-T细胞持续表达IL-12,在动物试验中让这些“武装”起来的CAR-T细胞能够克服肿瘤微环境的抑制作用。这一团队还设计出表达抗PD-1抗体的CAR-T细胞,消除免疫检查点蛋白对CAR-T细胞的抑制。
然而,让CAR-T细胞持续表达IL-12等促炎症细胞因子可能带来全身性的毒副作用,因为在全身血循环中流动的CAR-T细胞可以不断释放IL-12。为了对IL-12的释放进行调控,UCSF的Wendell Lim博士设计出了使用synNotch控制的治疗系统,通过synNotch来在肿瘤微环境中特异性释放IL-12等细胞因子,或者其它治疗性蛋白。这些手段都可以纳入CAR-T细胞的设计中,进一步增强CAR-T细胞克服肿瘤微环境的能力。
结语
合成生物学已经可以通过为CAR-T疗法增添基因回路,扩展疗法的可控性和适应能力。我们仍然需要更多的试验来证明这些新设计在临床情况下的效果和安全性。卢冠达博士在综述中同时指出,这些基因回路的复杂性意味着,将它们导入细胞并且整合入基因组将成为研发过程的瓶颈。我们需要更精简的基因回路设计和更有效的递送载体。
合成生物学在癌症治疗方面的应用仍然处于初级阶段,我们期待更多的基础科学、转化科学和临床研究让基于基因回路的细胞疗法在临床医药开发方面展现它的威力。(生物谷Bioon.com)
小编推荐会议 2019(第十届)细胞治疗国际研讨会
http://meeting.bioon.com/2019cell-therapies?__token=liaodefeng

版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


