Cancer Cell:张泽民院士团队揭示胰腺癌神侵犯的细胞亚型及分子机制
来源:生物世界 2025-07-19 17:06
该研究通过整合单细胞和空间转录组学,揭示了胰腺癌神经侵犯中涉及的不同细胞亚型,全面揭示了肿瘤相关神经的微环境特征,阐明了癌症-免疫-神经原位相互作用的关键机制。
胰腺神经分布密集,胰腺导管腺癌(PDAC)在各类癌症中神经侵犯(Neural Invasion,NI)的发生率最高(80%-100%)。神经侵犯也已被确认为胰腺癌预后不良的独立预测因素。鉴于神经侵犯在局部复发、转移和疼痛产生方面的重要作用,靶向神经侵犯可能是胰腺导管腺癌(PDAC)的一种治疗策略。
之前的研究强调了神经侵袭中癌细胞与神经之间相互信号转导的重要性,涉及神经营养因子、趋化因子和轴突导向分子。在体外模型和小鼠模型研究中,间质细胞和免疫细胞也被证明会对神经侵犯产生影响。然而,将这些发现转化为临床应用已被证明颇具挑战性。
该研究通过整合单细胞和空间转录组学,揭示了胰腺癌神经侵犯中涉及的不同细胞亚型,全面揭示了肿瘤相关神经的微环境特征,阐明了癌症-免疫-神经原位相互作用的关键机制,并为开发靶向神经侵犯的治疗策略提供了理论依据。

在这项最新研究中,研究团队对 25 例胰腺导管腺癌(PDAC)患者的 62 份样本进行了单细胞/单核 RNA 测序(sc/snRNA-seq)和空间转录组学分析 ,绘制了不同神经侵犯(NI)状态下肿瘤的细胞组成、谱系动态和空间组织结构。
结果显示,在低神经侵犯(low-NI) 肿瘤组织中,三级淋巴结构(tertiary lymphoid structures) 富集并与未受侵犯的神经共定位,而在高神经侵犯(high-NI) 组织中,NLRP3+ 巨噬细胞和癌症相关肌成纤维细胞包围受侵犯的神经。研究团队鉴定出了独特的神经内膜 NRP2+ 成纤维细胞群,并表征了三个不同的施万细胞亚群 。其中,TGFBI+ 施万细胞定位于神经侵犯前沿,可被 TGF-β 信号通路激活,促进肿瘤细胞迁移,并与患者不良预后相关。此外,他们还发现了具有独特形态特征的基底样恶性亚群和神经反应性恶性亚群 ,其神经侵犯能力显著增强。
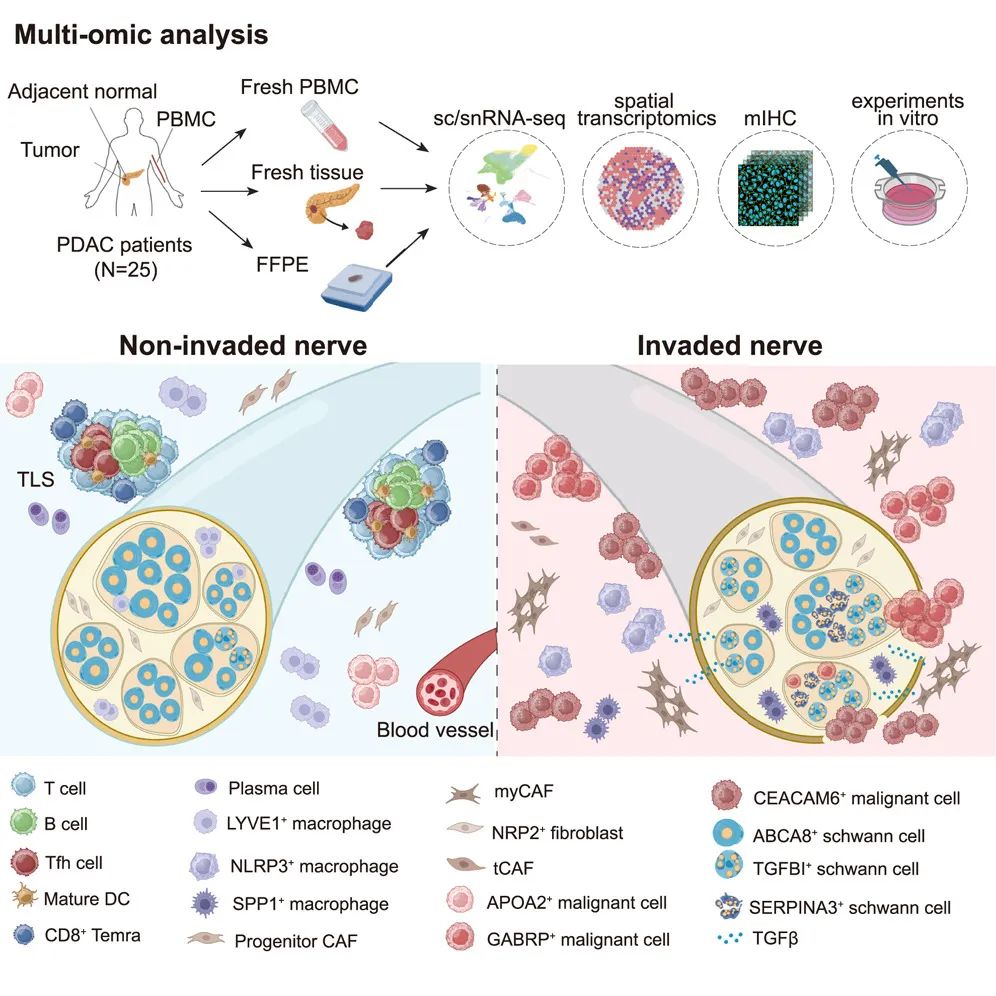
这一全景式研究揭示了肿瘤相关神经的微环境特征,阐明了癌症-免疫-神经原位相互作用的关键机制,并为开发靶向神经侵犯的治疗策略提供了理论依据。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


