中国学者一作Cell论文:添加一个关键“零件”,打造“超级CAR-T细胞”,攻克实体瘤
来源:生物世界 2025-12-07 09:40
这项研究为开发下一代更强大、更持久的的 CAR-T 细胞疗法提供了全新的思路,也为攻克实体瘤带来了新的希望。
目前的 CAR-T 细胞疗法,在多种血液类癌症以及自身免疫疾病中展现了强大的治疗效果,然而,对于占据癌症绝大多数的实体瘤,其疗效一直未能获得实质性突破。
2025 年 12 月 2 日,CAR-T 细胞疗法先驱 Michel Sadelain 教授(Shi Yuzhe 为论文第一作者)在国际大奖学术期刊 Cell 上发表了题为:pTα enhances mRNA translation and potentiates CAR T cells for solid tumor eradication 的研究论文。
该研究通过模拟 T 细胞天然发育中的强大增殖信号——pre-TCR,将其关键结构域 pTα-1A 整合到 CAR 结构中,在抗原刺激下通过持续激活 YBX1 以增强 mRNA 翻译,让 CAR-T 细胞具有更强的增殖能力、细胞因子产生能力和持久性,并伴有更低的耗竭,以及在多种血液类癌症和实体肿瘤模型中更长期的抗肿瘤能力。
这项研究为开发下一代更强大、更持久的的 CAR-T 细胞疗法提供了全新的思路,也为攻克实体瘤带来了新的希望。

Michel Sadelain 教授在 CAR-T 细胞疗法中取得了多项开创性突破,包括首次将 CD28 共刺激域引入 CAR 结构设计出第二代 CAR、证实了 CD19 可作为有效靶点等。近几年获得了包括科学突破奖、盖尔德纳奖、引文桂冠奖等科学大奖,被认为是诺贝尔奖的热门候选人。
CAR-T的“阿喀琉斯之踵”:实体瘤与细胞耗竭
CAR-T 细胞疗法在血液肿瘤中取得了革命性成功。然而,面对占癌症 90% 以上的实体瘤时,CAR-T 细胞却常常显得力不从心。究其根源,主要有两大难题:一是实体瘤的肿瘤微环境的抑制作用;二是 CAR-T 细胞在持续对抗肿瘤后,容易进入“耗竭”状态,就像士兵连续作战后疲惫不堪,失去战斗力。
科学家们一直在寻找让 CAR-T 细胞“续航”更久、战斗力更强的方法。而这项新研究的灵感,竟然来源于我们每个人体内都曾发生过的过程——T 细胞在胸腺中的发育。
灵感来源:胸腺中的“增殖风暴”
在我们体内,T 细胞诞生于胸腺。在发育过程中,会经历一个名为“β-选择”的关键节点。此时,未成熟的 T 细胞会表达一种名为“前 T 细胞受体”(pre-TCR)的蛋白。这个受体的激活会触发一场剧烈的“增殖风暴”,使得胸腺细胞在短时间内扩增上百倍,为后续筛选出多样化的 T 细胞大军奠定基础。
这项研究的核心思路就是:能否将胸腺细胞这种强大的增殖能力,“借给” CAR-T 细胞,让它也变得更强?
神来之笔:给 CAR-T 装上“增殖引擎”
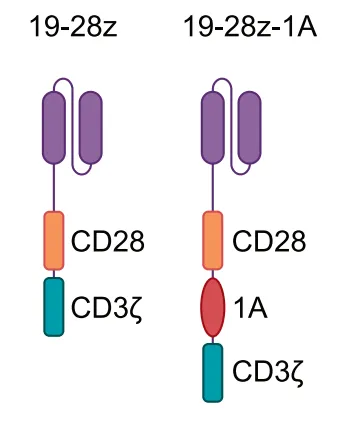
研究团队将目光聚焦于 pre-TCR 的一个独特组成部分——pTα 链。他们尝试将 pTα 链细胞内部分的一个关键区域——“1A 结构域”,整合到经典的 CD28-CAR(称为 19-28z)中。
经过多种构型的测试,他们最终找到了最优设计:将 1A 结构域插入到 CAR 的 CD28 和 CD3ζ 信号域之间,这个新型 CAR 结构被命名为——19-28z-1A。
效果惊人:新型 CAR-T 细胞表现超群
在体外反复用肿瘤细胞刺激时,19-28z-1A CAR-T 细胞展现出更强大的扩增能力和细胞因子(例如干扰素-γ、肿瘤坏死因子等)分泌水平。更重要的是,这种优势随着刺激次数的增加而愈发明显。
在白血病小鼠模型中,19-28z-1A CAR-T 细胞能更有效地清除肿瘤,小鼠存活率显著提高。分析发现,这些细胞在体内存活更久,数量更多,并且表达更少的耗竭标志物(例如 PD-1、LAG-3 等),意味着它们能更好地保持“年轻态”的战斗力。
那么,这个小小的 1A 结构域,是如何发挥如此巨大作用的呢?
机制揭秘:掌控蛋白质合成的“总开关”
通过磷酸化蛋白质组学分析,研究团队发现了一个关键蛋白——YBX1。YBX1 被称为 mRNA 翻译的“主调控因子”,它就像工厂的“生产调度员”,决定哪些 mRNA 可以被翻译成蛋白质。
研究团队发现,在抗原刺激后,19-28z-1A CAR-T 细胞能够比传统 CAR-T 细胞更持久地维持 YBX1 蛋白的磷酸化(激活状态)。这种持续激活的 YBX1,进而推动了一整套蛋白质翻译合成机器的高效运转,还促进了 IL-2、IFN-γ 等重要杀伤性细胞因子的翻译合成。
当研究团队敲除 YBX1 基因后,1A 结构域所带来的所有优势都消失了,CAR-T 细胞扩增受损,更快走向耗竭。这直接证明了 YBX1 是 1A 结构域发挥作用不可或缺的关键因素。
从血液瘤到实体瘤:广谱抗癌潜力初现
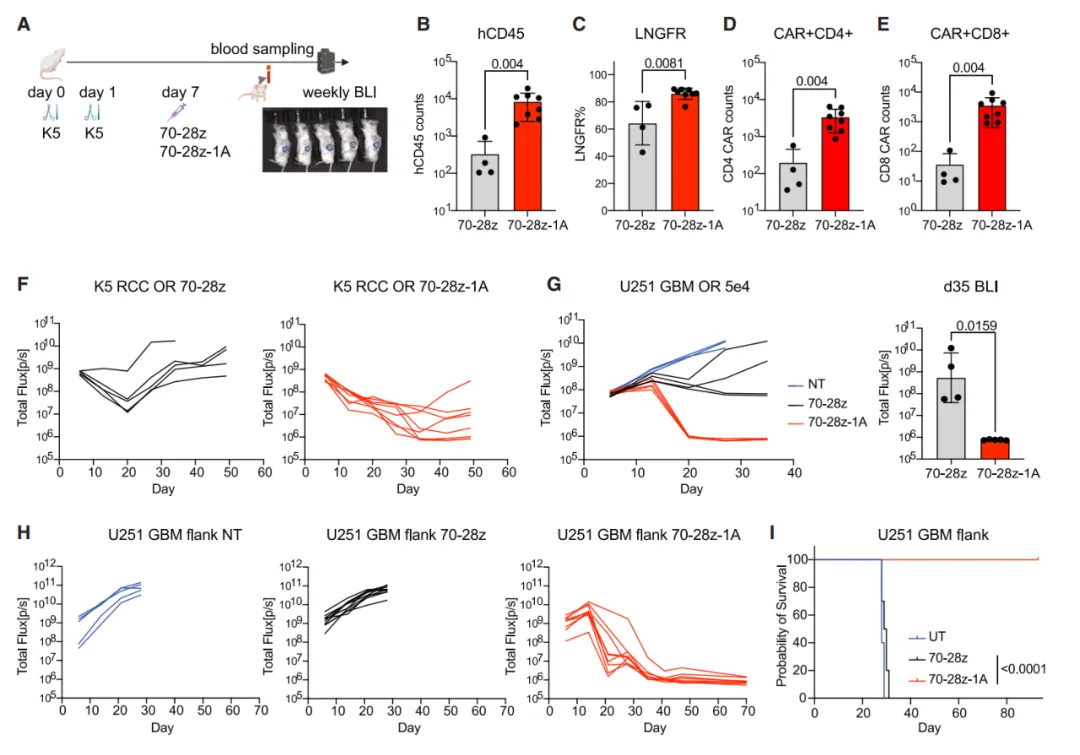
最后,研究团队将靶点从 CD19(血液类癌症靶点)换成了 CD70(肾细胞癌、胶质母细胞瘤等实体瘤靶点),构建了 70-28z-1A CAR-T 细胞。
结果令人振奋:在肾细胞癌原位模型中,70-28z-1A CAR-T 细胞在体内增殖更多,能有效控制肿瘤生长。在恶性程度极高的胶质母细胞瘤(GBM)模型中,无论是颅内原位肿瘤还是皮下肿瘤,70-28z-1A CAR-T 细胞都展现了强大的清除肿瘤的能力,而传统 CAR-T 细胞几乎无效。
强强联合:1A 与现有技术擦出更强火花
研究团队还将 1A 结构域与另一种先进的 CAR 设计——“1XX CAR”相结合。1XX 通过减少信号强度来降低细胞耗竭。而 1A 通过增强翻译来提升细胞功能,两者机制不同。结果显示,1XX-1A 这种“强强联合”的 CAR 结构,表现出了当前最强的抗肿瘤效果,为未来的临床开发提供了更优的选择。
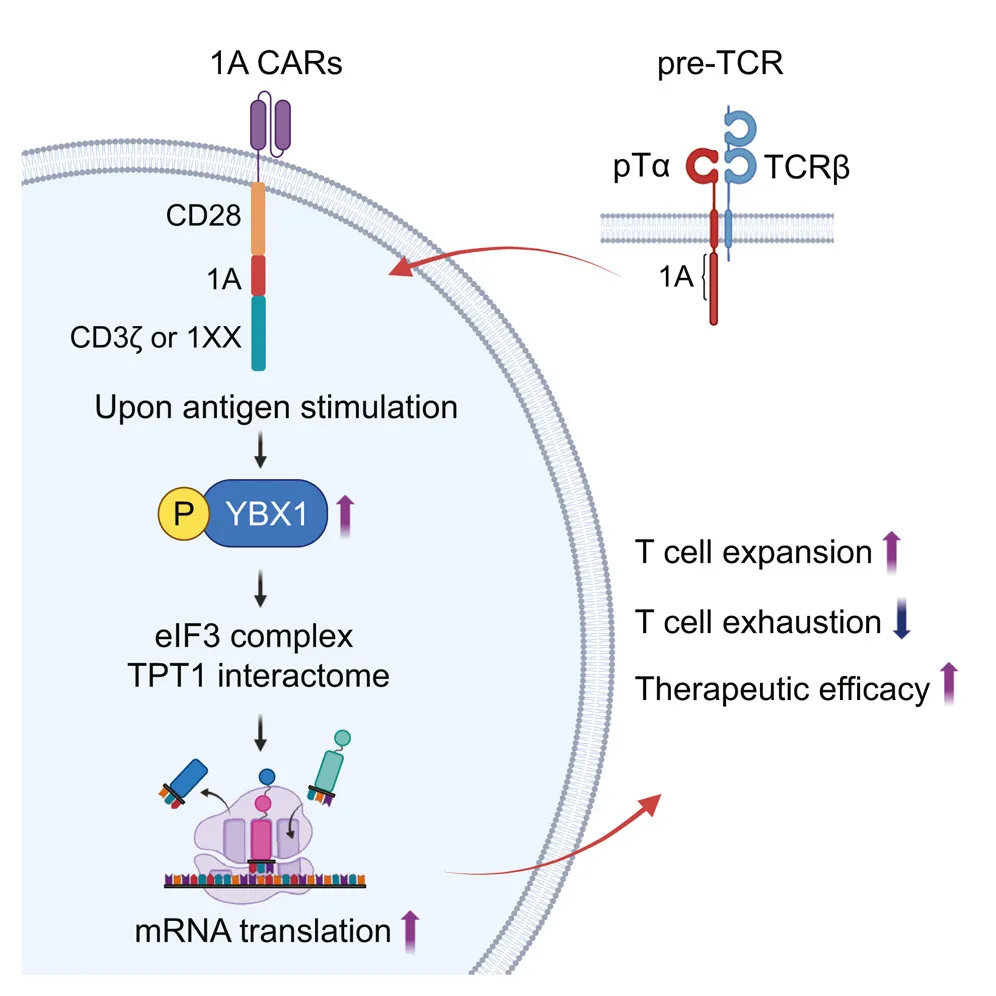
这项研究的意义重大,它开辟了 CAR-T 细胞疗法优化的一个新维度:通过调控 mRNA 翻译来重编程细胞状态。
创新性:不同于以往专注于调控转录因子或表观遗传,该研究另辟蹊径,从胸腺发育中汲取灵感,通过增强蛋白质合成这一基础生命活动来根本性地提升 T 细胞功能。
有效性:在多种临床前模型中证实了其对血液瘤,尤其是实体瘤的显著增强效果。
安全性:初步研究显示,1A CAR-T 细胞的激活仍依赖于抗原,在无肿瘤小鼠体内会正常清除,未发现自主增殖等安全隐患,具有良好的转化前景。
论文链接:
https://www.cell.com/cell/abstract/S0092-8674(25)01254-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


