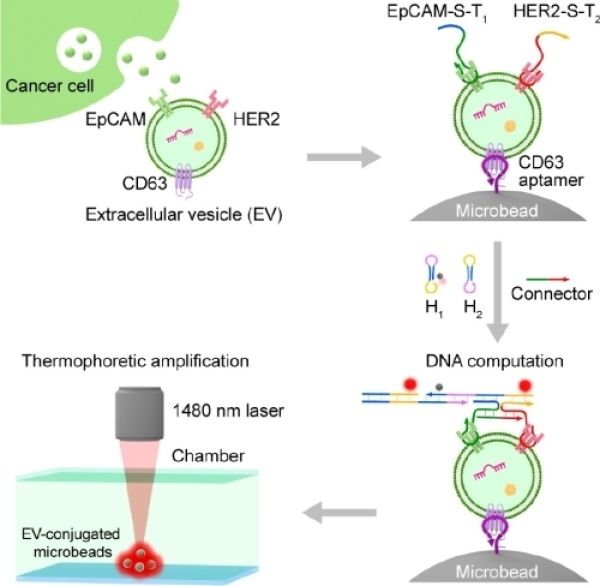
肿瘤细胞外囊泡DNA分子逻辑运算与乳腺癌分子分型研究获进展
近日,中国科学院国家纳米科学中心孙佳姝课题组与上海交通大学教授韩达课题组、中国人民解放军总医院第五医学中心教授张少华合作,在肿瘤细胞外囊泡DNA分子逻辑运算与乳腺癌分子分型研究方面取得进展。相关研究成果以Molecular Identification of Tumor-Derived Extracellular Vesicles U
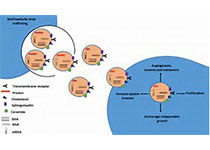
研究实现肿瘤衍生细胞外囊泡的分子识别
细胞外囊泡(EV)可以说是癌症诊断中的新生力量。细胞外囊泡属于膜结合的颗粒,在体内由各种细胞均可分泌,并参与细胞间通讯。分析EV中的生物标志物很有价值,因为EV中包含大量关于其组织来源的信息。肿瘤来源的细胞外囊泡(tdEV)可用于肿瘤诊疗的有希望的血液生物标志物。然而,血液是一种高度复杂的液体,在与tdEVs(30 nm-1μm)相同
一种外泌体来源的miRNA可改善肥胖小鼠的胰岛素敏感性
美国加州大学圣迭戈分校Jerrold M. Olefsky小组发现,MiR-690是一种M2极化型巨噬细胞外泌体来源的miRNA,可改善肥胖小鼠的胰岛素敏感性。相关论文于2021年1月14日在线发表在《细胞—代谢》杂志上。研究人员发现,M2极化型骨髓源性巨噬细胞(BMDM)能够分泌含miRNA的外泌体(Exo),当给予肥胖小鼠时,可改
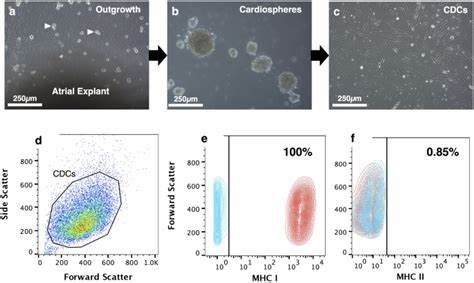
Science子刊:心脏球形干细胞移植有望治疗扩张型心肌病,并揭示这种疗法的作用机制
2021年1月17日讯/生物谷BIOON/---扩张型心肌病(dilated cardiomyopathy, DCM)是一种由心肌衰弱引起的影响心室的疾病。如果任其发展,DCM可导致心力衰竭和死亡,尤其是儿童。目前,唯一的治疗方法是心脏移植,但这也有其自身的挑战:漫长的等待时间以确保合适的供体心脏、器官排斥的可能性、漫长的住院和恢复时间等等。近几十年来,干细
肝癌细胞HepG2外泌体对其自身生长行为的影响及其机制研究
为了研究肝癌细胞HepG2外泌体对细胞增殖、迁移、周期和凋亡的影响及其机制,北华大学医学技术学院阴迪、王一涵、王奕丹等人培养肝癌细胞HepG2并用差速离心法提取其外泌体,采用粒径分析、透射电镜、蛋白质印迹法(Western blot)等方法对其进行鉴定。将外泌体与肝癌细胞HepG2共培养,采用细胞划痕实验比较其对细胞增殖能力的影响;采
EXODUS可有效分离纯化外泌体
温州医科大学Fei Liu和美国哈佛医学院Luke P. Lee研究小组合作研发了用于检测外泌体的超速隔离系统:EXODUS。相关论文于2021年1月11日发表在《自然-方法学》杂志上。研究人员研发了一种通过超速分离系统(EXODUS)来有效检测外泌体的方法,该方法可以从各种生物流体中自动无标记地纯化外泌体。研究人员通过负压振荡和双耦
2020年外泌体研究进展及其展望
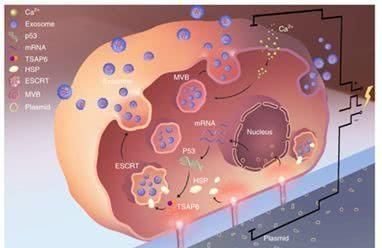
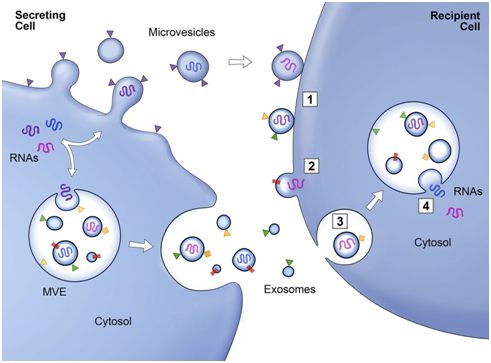
2020年12月31日讯/生物谷BIOON/---外泌体(exosome)是由大多数类型细胞分泌的微小膜囊泡。外泌体最早是指多囊泡胞内体(multivesicular endosome, MVE)的细胞区室与细胞膜融合后,释放到细胞外基质中的一种直径约30~120nm 的膜囊泡,现特指直径为直径在40~160nm(平均100nm)的膜囊泡。外泌体形成的第一步
制药巨头扎堆 外泌体赛道火热
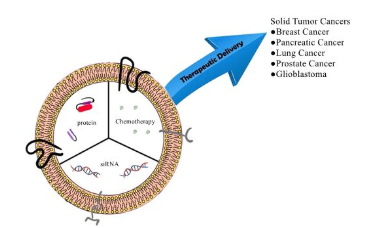
外泌体是来源于细胞内膜的纳米级囊泡,包含有核酸、蛋白和脂质等生命物质,作为一种细胞间交流的机制,在生命活动中发挥着重要作用。2013年,诺贝尔生理学或医学奖颁给了在细胞间囊泡运输调控机制领域作出突出贡献的科学家,将外泌体研究的热度推向高潮。近期,一系列涉及大型制药公司的交易提示产业界正对外泌体敞开怀抱,将其作为向难以到达的组织递送核酸疗法的手段。
多篇文章聚焦科学家们在中风研究领域取得的新成果!
本文中,小编整理了多篇重要研究成果,共同聚焦科学家们在中风研究领域取得的新成果!分享给大家! 【1】Science子刊:靶向抑制PI3KC2α有望预防心脏病和中风doi:10.1126/scitranslmed.aar8430在一项新的研究中,来自澳大利亚莫纳什大学的研究人员开发出一种有可能用于预防心脏病发作的药物,该药物抑制II类磷酸肌醇-3激酶
巨噬细胞来源外泌体介导心肌梗塞后心脏重塑的作用研究
为了研究活化的巨噬细胞来源外泌体在心肌梗塞后心脏重塑中的作用,上海交通大学附属第一人民医院蔡利栋,吴晓宇,丁羽等采用超高速离心分离提取溶血磷脂酸作用下巨噬细胞来源的外泌体,将其与心脏成纤维细胞共同孵育48小时,利用Edu细胞增殖实验,Transwell实验及免疫荧光等方法检测溶血磷脂酸刺激(LPS)下巨噬细胞来源外泌体对心脏成纤维细胞的增殖,迁移